
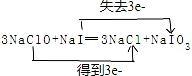 ,还原剂与氧化剂的物质的量之比是1:3.
,还原剂与氧化剂的物质的量之比是1:3. 分析 (1)①所含元素化合价降低的反应物为氧化剂,元素化合价升高得到氧化产物;
②根据方程式可知当有16molHCl参加反应,有10molHCl被氧化,6molHCl表现为酸性;结合氯原子守恒计算生成氯气物质的量,结合Cl元素化合价变化计算转移电子;
(2)①光导纤维原料为二氧化硅;
②水溶液中或在熔融状态下就能够导电化合物是电解质;水溶液中和在熔融状态下都不能够导电化合物是非电解质,单质与混合物既不是电解质,也不是非电解质;
③反应中次氯酸钠+1价氯化合价降为氯化钠中-1价,次氯酸钠为氧化剂,碘化钠中-1价碘化合价升高为碘酸钠中+5价碘,碘化钠为还原剂,3mol次氯酸钠反应得到3mol电子.
解答 解:(1)①反应中Mn元素化合价降低,KMnO4被还原,则为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,Cl2为氧化产物,
故答案为:KMnO4;Cl2;
②根据方程式可知当有16molHCl参加反应,有10molHCl被氧化,6molHCl表现为酸性,被氧化与未被氧化的HCl的质量之比为10:6=5:3,
n(HCl)=$\frac{7.3g}{36.5g/mol}$=0.2mol,则生成0.1molCl2,m(Cl2)=0.1mol×71g/mol=7.1g,转移电子为0.2mol,
故答案为:5:3;7.1;0.2.
(2)①光导纤维原料为二氧化硅,化学式为:SiO2;
故答案为:SiO2;
②:①铜是单质,既不是电解质,也不是非电解质;
②蔗糖溶于水溶液中和在熔融状态下都不能够导电化合物,是非电解质;
③熔化的KNO3溶于水溶液中或在熔融状态下就能够导电化合物,是电解质;
④BaSO4熔融状态下就能够导电化合物,是电解质;
⑤氯化镁溶液,是混合物,既不是电解质,也不是非电解质;
属于电解质的是③④,属于非电解质的是②;
故答案为:③④;②;
③3NaClO+NaI═3NaCl+NaIO3反应中次氯酸钠+1价氯化合价降为氯化钠中-1价,次氯酸钠为氧化剂,碘化钠中-1价碘化合价升高为碘酸钠中+5价碘,碘化钠为还原剂,3mol次氯酸钠反应得到3mol电子,用双线桥表示为: ,还原剂与氧化剂物质的量之比为:1:3;
,还原剂与氧化剂物质的量之比为:1:3;
故答案为: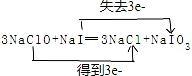 ;1:3.
;1:3.
点评 本题考查考查氧化还原反应、电解质与非电解质,属于拼合型题目,根据化合价变化理解氧化还原反应基本概念,结合电子转移守恒计算有关计算,注意把握电解质与非电解质概念.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 门捷列夫利用软锰矿和浓盐酸反应制得了氯气 | |
| B. | 利用火力发电厂及核电站用于冷却的循环海水来提取单质溴以减少能耗 | |
| C. | 含重金属离子的污水的排放产生“赤潮”或“水华”等水污染现象 | |
| D. | 钢化玻璃、有机玻璃、防弹玻璃均属于硅酸盐材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16g CH4所含原子数目为NA | |
| B. | 1mol•L-1 NaCl溶液含有NA个Na+ | |
| C. | 常温常压下,22.4L CO2中含有NA个CO2分子 | |
| D. | 2.4g Mg与足量盐酸反应转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(F-)>c(OH-)>c(HCN)>c(HF) | B. | c(F-)+c(HF)>c(CN-)+c(HCN) | ||
| C. | c(OH-)>c(F-)>c(CN-)>c(H+) | D. | c(OH-)>c(HF)>c(HCN)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .化合物A~H的转化关系如图所示,B1和B2互为同分异构体,B1的摩尔质量80g/mol;G1和G2互为同分异构体,核磁共振氢谱显示二者均只有两种氢,G1无甲基.请完成下列问题.
.化合物A~H的转化关系如图所示,B1和B2互为同分异构体,B1的摩尔质量80g/mol;G1和G2互为同分异构体,核磁共振氢谱显示二者均只有两种氢,G1无甲基.请完成下列问题.
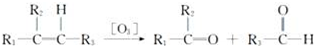
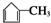 ,G2所含官能团为醛基、羰基.
,G2所含官能团为醛基、羰基.
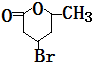 +H2O.
+H2O. .
.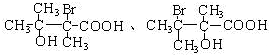 任意一种.
任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
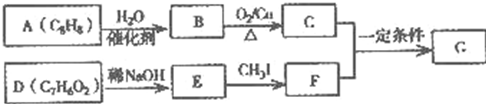


 .
. .
. .
. (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽车尾气、工业废气的排放是形成“雾霾”的主要原因 | |
| B. | 用铝制容器盛放浓硫酸,是因为铝和浓硫酸不反应 | |
| C. | 不锈钢比普通钢抗腐蚀能力强,是因为表面镀了一层铬 | |
| D. | “辽宁舰”用于舰载机降落阻拦索的是一种特种钢缆,属于新型无机非金属材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com