
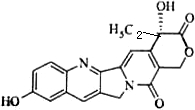
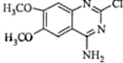
 (2009?江苏)具有显著抗癌活性的10-羟基喜树碱的结构如图所示.下列关于10-羟基喜树碱的说法正确的是( )
(2009?江苏)具有显著抗癌活性的10-羟基喜树碱的结构如图所示.下列关于10-羟基喜树碱的说法正确的是( )

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2009?江苏)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物.
(2009?江苏)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物.| c(V2-4V1) |
| 4V |
| c(V2-4V1) |
| 4V |
查看答案和解析>>
科目:高中化学 来源: 题型:
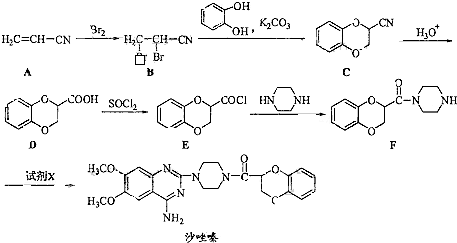
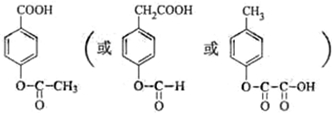

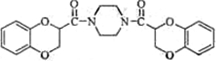


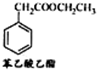
| ||
| 170℃ |
| Br2 |
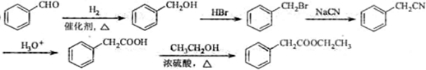

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
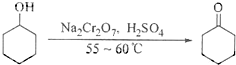
| 物质 | 沸点(℃) | 密度(g-cm-3,200C) | 溶解性 |
| 环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水 |
| 环己酮 | 155.6(95)* | 0.9478 | 微溶于水 |
| 水 | 100.0 | 0.9982 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com