
 氯及其化合物在生产、生活中有广泛的用途.回答下列问题:
氯及其化合物在生产、生活中有广泛的用途.回答下列问题:| 容器编号 | 温度/ | 容器体积/L | ClO2(g)的平衡转化率 |
| a | T1 | V1=1L | 75% |
| b | T2 | V2 | |
| c | T3 | V3 | 75% |
| d | |||
| e |
分析 (1)已知信息:Cl2将废水中的CN-氧化成无毒的N2和CO2,结合离子方程式的书写方法来书写;
(2)化学反应焓变△H=反应物总键能-生成物总键能,据此计算;
(3)反应达到滴定终点,测得溶液中CrO42-的浓度是5.00×10-3mol•L-1,结合Ksp(Ag2CrO4)=2.00×10-12计算银离子浓度,利用Ksp(AgCl)=1.78×10-10,计算氯离子浓度;
(4)①4ClO2)(g)?2Cl2O(g)+3O2(g),反应中氯元素化合价+4价变化为+2价,化合价降低做氧化剂被还原;
②结合化学平衡三行计算得到平衡浓度,平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
③已知:T3>T1,V2>V1.T1、T3状态下ClO2(g)的平衡转化率相同为相同平衡状态,反应为吸热反应,升温平衡正向进行;
④压强增大平衡逆向进行,ad为加入催化剂达到的相同平衡状态,d压强大平衡逆向进行;
解答 解:(1)根据已知信息:Cl2将废水中的CN-氧化成无毒的N2和CO2,离子方程式为:5Cl2+2CN-+8OH-═10Cl-+N2↑+2CO2↑+4H2O,
故答案为:5Cl2+2CN-+8OH-═10Cl-+N2↑+2CO2↑+4H2O;
(2)地康法制备氯气的反应为4HCl(g)+O2(g)$\frac{\underline{\;CuO/CuCl_{2}\;}}{400℃}$2Cl2(g)+2H2O(g)△H=-115.6kJ•mol-1,1molH-Cl、1molCl-Cl、1molO-O断裂时分别需要吸收431J、243kJ、489kJ的能量,则1molO-H断裂时需吸收的能量为x,
则△H=4×431J+489kJ-2×243kJ-2×2×x=-115.6kJ•mol-1,x=460.65KJ,
故答案为:460.65KJ;
(3)在水样中加入几滴K2CrO4溶液作指示剂,用一定浓度AgNO3溶液滴定,当有砖红色的Ag2CrO4沉淀出现时,反应达到滴定终点,测得溶液中CrO42-的浓度是5.00×10-3mol•L-1,结合Ksp(Ag2CrO4)=2.00×10-12计算银离子浓度c2(Ag+)=$\frac{2.00×1{0}^{-12}}{5.00×1{0}^{-3}}$(mol/L)2,c(Ag+)=2×10-5mol/L,则滴定终点时溶液中c(Cl-)=$\frac{1.78×1{0}^{-10}}{2×1{0}^{-5}}$=8.90×10-6mol/L,
故答案为:8.90×10-6mol/L;
(4)①ClO2(g),4ClO2)(g)?2Cl2O(g)+3O2(g),反应中氯元素化合价+4价变化为+2价,化合价降低做氧化剂被还原,则该反应中Cl2O是还原产物,
故答案为:还原产物;
②恒温、恒容密闭容器中充入4mol,T1时ClO2(g)的平衡转化率为75%,V1=1L,
4ClO2(g)?2Cl2O(g)+3O2(g),
起始量(mol/L) 4 0 0
变化量(mol/L) 4×75% 1.5 2.25
平衡量(mol/L) 1 1.5 2.25
K=$\frac{2.2{5}^{3}×1.{5}^{2}}{{1}^{4}}$=25.63,
故答案为:25.63;
③已知:T3>T1,V2>V1.T1、T3状态下ClO2(g)的平衡转化率相同为相同平衡状态,反应为吸热反应,升温平衡正向进行,则V2>V3,
故答案为:>;
④d、c两容器中的反应与a容器中的反应均各有一个条件不同,a、d、e三容器中反应体系总压强随时间的变化如图所示,ad最后达到相同平衡状态,d达到平衡时间缩短,但最后压强相同,说明d是加入催化剂,改变反应速率不改变化学平衡,e状态下压强大,增大压强平衡逆向进行,转化率减小,a、d、e三容器中ClO2的平衡转化率由大到小的排列顺序为:e<a=d,
故答案为:e<a=d;加入催化剂;ad图象中曲线变化可知,d反应速率增大,压强不变平衡点不变;
点评 本题考查了氧化还原反应、反应焓变和键能的定量计算、溶度积常数的计算、化学平衡影响因素等知识点,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3p轨道上有2个未成对电子的原子和4p轨道上有2个未成对电子的原子 | |
| B. | 3p轨道上只有1个空轨道的原子和4p轨道上只有1个空轨道的原子 | |
| C. | 最外层电子排布为1s2的原子和最外层电子排布为2s2的原子 | |
| D. | 最外层电子排布为3s2的原子和最外层电子排布为4s2的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:1:4 | B. | 2:1:1 | C. | 1:1:1 | D. | 1:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
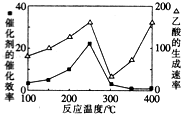 CO2和CH4是两种主要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究目标.
CO2和CH4是两种主要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究目标.| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
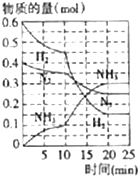 氨、烧碱在工农业生产和工业废水处理中具有广泛用途.回答下列问题:
氨、烧碱在工农业生产和工业废水处理中具有广泛用途.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2 (g)?2SO3(g) (△H<0)
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2 (g)?2SO3(g) (△H<0)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
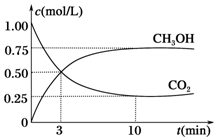 2009年10月15日新华社报道:全国农村应当在“绿色生态•美丽多彩•低碳节能•循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设.可见“低碳循环”已经引起了国民的重视,试回答下列问题:
2009年10月15日新华社报道:全国农村应当在“绿色生态•美丽多彩•低碳节能•循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设.可见“低碳循环”已经引起了国民的重视,试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com