
【题目】实验室里需要纯净的氯化钠溶液,但手边只有混有Na2SO4、NH3HCO3 等杂质 的NaCl。某学生设计了如下图方案提取纯净物的NaCl溶液(已知:NH4HCO3![]() NH3↑+H2O+CO2↑)
NH3↑+H2O+CO2↑)
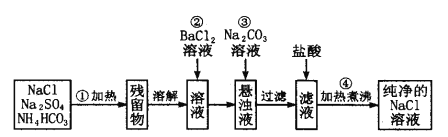
如果此方案正确,那么:
(1)操作①可选择_______ 或__________(仪器)。
(2)操作②为什么不用加硝酸钡溶液?其理由是___________。
(3)进行操作②后,如何判断SO42-已除尽的方法是__________ 。
(4)操作③的目的是________,写出此操作涉及的离子方程式:___________
(5)操作④的目的是_________。
【答案】蒸发皿 坩埚 改用Ba(NO3)2会使溶液中引入新的杂质离子NO3- 取少量上层澄清溶液,再滴加BaCl2溶液,如无沉淀出现则说明SO42-已除尽,反之则有(或其他的方法) 除去过量的Ba2+ Ba2++ CO32-= BaCO3 ↓ 除去溶解在溶液中的CO2和HCl
【解析】
根据题中的信息,将物质的除杂流程详细化:
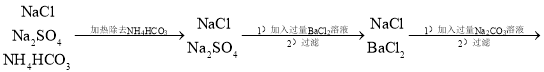
![]() ,其中加入过量BaCl2是为了除去Na2SO4,加入过量的Na2CO3溶液是为了除去BaCl2,加入过量的HCl是为了除去Na2CO3,多余的盐酸通过加热煮沸可以使HCl从水中逸出,同时还能使微溶于水的CO2也逸出,从而得到纯净的NaCl溶液。
,其中加入过量BaCl2是为了除去Na2SO4,加入过量的Na2CO3溶液是为了除去BaCl2,加入过量的HCl是为了除去Na2CO3,多余的盐酸通过加热煮沸可以使HCl从水中逸出,同时还能使微溶于水的CO2也逸出,从而得到纯净的NaCl溶液。
(1)加热固体,可以在坩埚中进行,也可以在蒸发皿中进行;
(2)操作②中,如果加入的是Ba(NO3)2溶液,则生成物里有NaNO3,即引入了新杂质离子NO3-;
(3)检验SO42-的操作为:取少量上层澄清溶液,再滴加BaCl2溶液,如无沉淀出现则说明SO42-已除尽,反之则有;
(4)操作③中,加入Na2CO3溶液是为了除去Ba2+,相关的离子方程式为:Ba2++CO32-=BaCO3 ↓;
(5)操作④的目的是除去溶解在溶液中的CO2和HCl。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)写出与环辛四烯![]() 互为同分异构体且属于芳香烃的分子的结构简式:_____________
互为同分异构体且属于芳香烃的分子的结构简式:_____________
(2)用系统命名法对下列有机物进行命名:
CH3C(CH3)=CHCH3:______________
CH3CH(CH2CH3)CH(CH3)CH2CH3:_________________________
(3)某烷烃A蒸气密度是相同状况下氢气密度的64倍,经测定知A分子中共含6个甲基。
①若A不可能是氢气与烯烃加成的产物,A的结构简式为____________;
②若A是炔烃与氢气加成的产物,A的结构简式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苋菜甲素、3-丁烯基苯酞、藁本内酯是传统中药当归、川芎中的活性成分。下列有关说法正确的是( )

A.苋菜甲素、藁本内酯互为同分异构体
B.1 mol 3-丁烯基苯酞与溴水反应最多消耗4 mol Br2
C.3-丁烯基苯酞通过还原反应可制得苋菜甲素
D.藁本内酯与足量H2加成的产物分子中含有2个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某矿渣的成分为Cu2O、Al2O3、Fe2O3、FeO、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如图:

已知:①Cu2O+2H+=Cu+Cu2++H2O。
②部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 2.7 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.7 | 8.8 |
(1)为了加快反应Ⅰ的速率,可以采取的措施是__(任写1条)。
(2)固体混合物A中的成分是__。
(3)反应Ⅰ完成后,铁元素的存在形式为__(填离子符号);检验该离子常用的方法之一是:取少量含该离子的溶液于试管中,滴加几滴铁氰化钾溶液,会产生沉淀,写出该反应的离子方程式__。
(4)操作1主要包括:__、__、__。洗涤CuSO4·5H2O粗产品不能用大量水洗,而用冰水洗涤。原因是__。
(5)用NaClO调pH可以生成沉淀B,利用题中所给信息分析沉淀B为__,该反应中氧化剂与还原剂的物质的量之比为__。
(6)用NaOH调pH可以生成沉淀C,利用题中所给信息分析y的范围为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
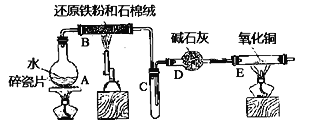
回答下列问题:
(1)装置B中发生反应的化学方程式是__________
(2)E中出现______________的现象。
(3)该小组把B中反应后的产物加入足量的盐酸,用该溶液制取FeCl3·6H2O晶体。
①欲检验溶液中含有Fe3+,选用的试剂为____________,现象是__________
②该实验小组同学用上述试剂没有检测到Fe3+,用离子方程式解释滤液中不存在Fe3+可能的的原因:___________。
③将此滤液中FeCl2完全氧化为FeCl3最好选择_______做氧化剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铝锂(LiAlH4)以其优良的还原性能在医药、香料、农药、染料等行业中广泛应用。纯氢化铝锂是一种白色晶状固体,熔点 125℃,加热至 130℃时分解,溶于醚、四氢呋喃,在 120℃以下和干燥的空气中相对稳定,但遇水即爆炸性反应。目前世界上有四种工业生产 LiAlH4的方法,其中施莱兴格(Schlesinger)法和高压合成法最为常见。
Ⅰ. 施莱兴格(Schlesinger)法

Ⅱ.高压合成法

请根据题中信息回答以下问题:
(1)Schlesinger 中的反应器需要附加电磁搅拌器,目的是________。
(2)Schlesinger 的反应器中发生的化学反应方程式是________。
(3)采用 Schlesinger 时需要使用大量高纯度氩气,氩气的作用是________。
(4)为了降低成本,在 Schlesinger 工艺中有一种原料可以循环使用,这种原料是________。
(5)已知乙醚沸点为 35℃,某工厂准备在蒸发室采用减压蒸发分离出产品,你认为有无必要,请简述理由________。
(6)两种工艺均使用过滤器,中学实验室中过滤装置需要的玻璃仪器有________。
(7)使用氢化铝锂要注意安全, 少量未反应完的需要分解处理。其中一种处理方法是向其中缓慢加入适量的稀盐酸,待无气体放出后视为处理完全。请写出此过程的化学反应方程式______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能电池在日常生活中已广泛应用,一种替代硅光电池的全天候太阳能电池已投入商用,其工作原理如图。下列说法不正确的是()
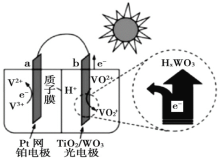
A.硅太阳能电池工作原理与该电池不相同
B.夜间时,该电池相当于蓄电池放电,a 极发生氧化反应
C.光照时,b 极的电极反应式为VO2+﹣e﹣+H2O=VO![]() +2H+
+2H+
D.光照时,每转移 1mol 电子,有 2 mol H+ 由 b 极区经质子交换膜向 a 极区迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此,下列说法错误的是( )

A.该硫酸的物质的量浓度为18.4mol·L-1
B.该硫酸与等体积的水混合所得溶液的质量分数大于49%
C.该硫酸与等体积的水混合所得溶液的浓度大于9.2 mol·L-1
D.实验需要248mL 4.6mol·L-1的稀硫酸,配制时需量取该浓硫酸50.0mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿中提取铝的工艺流程如下图所示,回答下列问题:

(1)气体X是___________(填化学式)。
(2)写出反应①、反应②的离子方程式:
①_________________________________;②_________________________________。
(3)操作1和操作2都是_____________,该操作要用到的玻璃仪器是:_______、____、_______。
(4)冰晶石的作用是_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com