
【题目】实验室需要制备纯净的氯化钾。现有含少量KBr和K2SO4的氯化钾样品,按照下图所示的实验方案进行提纯。

(1)KCl中K+检验时,透过蓝色钴玻璃观察焰色为:___________。
(2) 若用硝酸钡来代替氯化钡,请判断是否可行:______(填“是”或“否”),并说明理由:________。
(3)在过滤后的滤液中通入过量氯气即可将滤液中的KBr杂质除去,发生的反应为:2KBr + Cl2 = 2KCl + Br2,如果按是否有元素的化合价发生了变化来分类,该反应属于_______________反应。
(4) 某同学认为该实验方案中加适量氯化钡溶液不容易控制,应加入过量氯化钡溶液,他的思路如下。请写出沉淀A的化学式:A:_________。

【答案】紫色 否 会引入硝酸根离子 氧化还原 BaCO3
【解析】
(1)根据钾元素的检验方法进行分析;
(2)若用硝酸钡来代替氯化钡,则硝酸根离子在溶液中不能除掉;
(3)根据氧化还原反应的特征进行分析;
(4)碳酸钾和氯化钡反应生成碳酸钡白色沉淀和氯化钾,据此进行分析。
(1)KCl中K+检验时,透过蓝色钴玻璃观察,滤去黄色光的干扰,其焰色为紫色;
故答案是:紫色;
(2)硝酸盐均溶于水,若用硝酸钡来代替氯化钡,则硝酸根在溶液中不能除掉,所以不能用硝酸钡来代替氯化钡;
故答案是:否;会引入硝酸根离子;
(3)针对2KBr+Cl2=2KCl+Br2反应,KBr→Br2,溴元素化合价升高,Cl2→KCl,氯元素化合价降低,该反应发生前后有元素的化合价发生变化,因此该反应属于氧化还原反应;
故答案是:氧化还原;
(4)根据流程可知溶液①的成分中含有:氯化钾、溴化钾和过量的氯化钡,加入碳酸钾,会和氯化钡反应生成碳酸钡白色沉淀和氯化钾,所以沉淀A的化学式是BaCO3;
故答案是:BaCO3。


科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2 L的密闭容器中,发生下列反应:3A(g)+B(g)=xC(g)+2D(g)。经5 min时测得D的浓度为1 mol·L-1,c(A):c(B)=3:5,C的平均反应速率是0.3 mol·L-1·min-1,求
(1)x值是多少? ___________
(2)5 min 时A的物质的量为多少?_____________
(3)B的平均反应速率为多少?___________
(4)B的转化率为多少?____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t ℃下,某反应达到平衡,平衡常数 ![]() 。恒容时,温度升高,NO浓度减小。下列说法正确的是( )
。恒容时,温度升高,NO浓度减小。下列说法正确的是( )
A. 该反应正反应的焓变为正值 B. 恒温下扩大容器体积,反应体系的颜色加深
C. 升高温度,逆反应速率减小 D. 该反应化学方程式为NO2+SO2 ![]() NO+SO3
NO+SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝在生活中具有广泛用途。现从含铝废料(含有A12O3的质量分数为51%,其余为NiO、SiO2、Fe3O4)中制取金属铝的流程如下:

回答下列问题:
(1)工艺过程中常把废料研细,其目的是_________________________________。
(2)步骤I中得到的滤渣的主要成分是___________(填化学式)。步骤V的反应类型是______________________。
(3)步骤Ⅱ中加入稀双氧水的目的是______________________。
(4)步骤Ⅲ产生NiCO3的离子方程式是___________。步骤Ⅳ产生沉淀的离子方程式是______________________。
(5)工业中常用惰性电极熔融电解法制备金属铝,其阴极反应式为___________。
(6)若用a吨该含铝废料通过上述流程,理论上可以生产铝___________吨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题研究小组设计如下图所示装置(电极材料均为铂),该装置可将工业废水中的乙胺(CH3CH2NH2)转化成无毒无害物质。下列分析错误的是

A. 电极N为电池的负极
B. 电池工作时,H+由右极区通过交换膜移动到左极区
C. N电极的电极反应方程式为2CH3CH2NH2+8H2O-30e-=4CO2↑+N2↑+30H+
D. 当空气(假设含氧气20%)的进入量为7.5mol时,可以处理含乙胺9%(质量分数)的废水0.1kg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
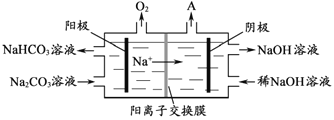
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。
(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲基丙烯酸缩水甘油酯(GMA)主要用于高分子胶囊、离子交换树脂和印刷油墨的粘合剂。其合成路线如下:

请回答下列问题:
(1)GMA中的官能团名称是_________________________________。
(2)甘油的结构简式是___________,F的结构简式___________。
(3)请写出B→C、D→E的化学方程式,并判断反应类型:
B→C:_________________________________、___________反应;
D→E:_________________________________、___________反应。
(4)E的核磁共振氢谱峰面积之比由大到小为___________,E的同分异构体中能发生水解反应的链状化合物有___________种。
(5)已知CH2=CH2能在Ag作催化剂的条件下与O2反应生成![]() ,据此请设计一条由丙烯生成F的路线。____________________________________________。
,据此请设计一条由丙烯生成F的路线。____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图(如图),电解总反应为:2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是
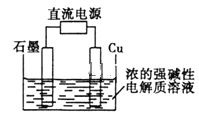
A. 电子的流向:电源负极→石墨电极→Cu→电源正极
B. 铜电极上的电极方程式为2Cu+H2O-2e-=Cu2O+2H+
C. 电解后溶液的pH变大
D. 当有0.1mol电子转移时,有0.1mol Cu2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
A. ![]() mol·L-1B.
mol·L-1B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1D.
mol·L-1D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com