
【题目】下列说法正确的是( )
A. Na2O2、NaClO中所含化学键类型完全相同
B. 只有活泼金属与活泼非金属元素之间才能形成离子键
C. D2O和T2O含有同种元素
D. 氯气与NaOH反应的过程中,同时又离子键、极性键和非极性键的断裂和形成
 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】如图所示为元素周期表的一部分,其中X、Y、Z、W为四种短周期元素。Z元素原子核外K层与M层上的电子数相等。下列说法中正确的是( )
![]()
A. Y元素的最高价氧化物对应的水化物的化学式为H3YO4
B. Y的最简单气态氢化物的水溶液显弱碱性
C. 原子半径由小到大的顺序为X<Z<Y<W
D. X、Z两种元素的氧化物中所含化学键的类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6。其流程如下:

已知:HCl的沸点是-85.0℃,HF的沸点是19.5℃。
(1)第①步反应中无水HF的作用是________、__________。反应设备不能用玻璃材质的原因是______________(用化学方程式表示)。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的____________溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式:________________。
(3)第④步分离采用的方法是_____________;第⑤步分离尾气中HF、HC1采用的方法是____________。
(4)LiPF6产品中通常混有少量LiF。取样品wg。测得Li的物质的量为nmol,则该样品中LiPF6的物质的量为__________mol(用含有w、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分物质与条件已略去,其中反应②的条件是“700℃,催化剂”).G是常见的红色金属单质,B、H是空气的主要成分,A、C、E均是常见气体,D是最常见的无色液体. 
请回答下列问题:
(1)E的化学式为 .
(2)A的电子式为 .
(3)写出反应①的离子方程式: .
(4)写出反应②的化学方程式,并标出电子转移的方向与数目: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】家用天然气的主要成分是烷烃,其中甲烷(CH4)占绝大多数,已知氧气约占空气体积的20%,出现燃气泄漏时如果遇到火花会引起爆炸,当泄漏的甲烷与空气体积比为1:10时,爆炸最剧烈,此时甲烷与氧气的质量比约为
A.1:2B.2:1C.1:4D.4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用A+、B﹣、C2﹣、D、E、F分别表示含有18个电子的几种微粒(离子或分子),请回答下列问题:
(1)A元素是________、B元素是________、C元素是________(用元素符号表示).
(2)D是由两种元素组成的双原子分子,用电子式表示其形成过程________.
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是________,其与水反应的化学方程式为________.
(4)F分子中含有6个原子,其化学式是________或________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水中含有CN-和Cr2O72-等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
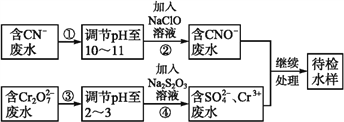
回答下列问题:
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为_______________。
(2)步骤④的反应为S2+Cr2O72-+H+![]() SO42-+Cr3++H2O(未配平), 则每消耗0.4 molCr2O72-转移转移____mol e-。
SO42-+Cr3++H2O(未配平), 则每消耗0.4 molCr2O72-转移转移____mol e-。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是_________________。
(4)在25 ℃下,将a mol·L-1的NaCN溶液与0.01 mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,用含a的代数式表示HCN的电离常数Ka=____。若25 ℃时将浓度均为0.1 mol·L-1的NaCN、HCN溶液等体积混合后,溶液呈碱性,则关于该溶液的说法不正确的是____(填字母)。
a.此溶液一定有c(Na+)+c(H+)=c(OH-)+c(CN-)
b.此溶液一定有c(Na+)=c(HCN)+c(CN-)
c.混合溶液中水的电离程度一定大于该温度下纯水的电离程度
d.此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大
(5)除去废水中的阳离子:取水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入一定量的Na2S溶液,蓝色沉淀转化成黑色沉淀。该过程中反应的离子方程式为_______、___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com