
| A. | 3n | B. | 3n-8 | C. | -3n | D. | 8-3n |
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
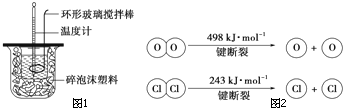 针对化学反应中的能量变化解决下列问题.
针对化学反应中的能量变化解决下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外的电子总是尽先排在能量高的电子层里,然后才排在能量低的电子层 | |
| B. | 某原子的核电荷数与最外层电子数相等 | |
| C. | 原子核外的电子层分为七层,每层所排的电子数相同 | |
| D. | 某原子M层上电子数是L层上电子数的4倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A沸点比B高 | |
| B. | A相对密度比B小 | |
| C. | 一般情况下,同碳原子的烷烃的沸点和密度低于烯烃 | |
| D. | 已知A在常温下为液态,则B不可能为气态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25 | B. | 0.025 | C. | 30.25 | D. | 27.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 2,3,4,5-四甲基己烷
2,3,4,5-四甲基己烷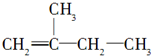 2-甲基-1丁烯
2-甲基-1丁烯 .
. .
. 分子式为C10H20,按碳的骨架分,该有机物属于ab.(填字母序号)
分子式为C10H20,按碳的骨架分,该有机物属于ab.(填字母序号)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com