
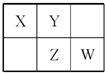
 四种短周期元素在周期表中的相对位置如图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
四种短周期元素在周期表中的相对位置如图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍. (写结构式);
(写结构式); ;
;分析 Z元素原子核外电子总数是其最外层电子数的3倍,由Z在周期表中的位置可知,Z应位于第三周期,设核外最外层电子数为x,则有:(2+8+x)=3x,x=5,则Z为P元素,结合元素在周期表中的相对位置可知X为C元素,Y为N元素,W为S元素,结合元素周期律的递变规律判断元素对应的单质、化合物的性质.
解答 解:Z元素原子核外电子总数是其最外层电子数的3倍,由Z在周期表中的位置可知,Z应位于第三周期,设核外最外层电子数为x,则有(2+8+x)=3x,x=5,则Z为P元素,结合元素在周期表中的相对位置可知X为C元素,Y为N元素,W为S元素,
(1)Z为P,原子核外有3个电子层,最外层电子数为5,应位于周期表第三周期第ⅤA族,故答案为:三;VA;
(2)这些元素的氢化物中,水溶液呈碱性的为NH3,氨气分子中含有3个氮氢键,其结构式为 ,故答案为:
,故答案为: ;
;
(3)XW2为CS2,为共价化合物,S和C之间存在S=C键,和CO2结构相似,电子式为 ,故答案为:
,故答案为: ;
;
(4)Y为N元素,W为S元素,形成的化合物中S的质量分数为70%,则S和N原子个数比为:$\frac{70%}{32}$:$\frac{30%}{14}$=1:1,其相对分子质量在170~190之间,设化学式为(SN)x,当x=4时,(32+14)×4=184,满足相对分子质量在170~190之间,
故答案为:S4N4.
点评 本题考查位置结构性质的相互关系应用,为高考常见题型,综合考查学生的分析能力,题目难度中等,试题侧重于原子结构的考查注意原子核外电子的排布特点以及元素在周期表中的相对位置,注意把握电子式的书写方法.


科目:高中化学 来源: 题型:选择题
| A. | R为第ⅣA族元素 | B. | R的气态氢化物为H2R | ||
| C. | R能形成含氧酸H2RO4 | D. | R气态氢化物水溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,取代反应
,取代反应 ,取代反应
,取代反应查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷不能发生加成反应,而乙烯能发生加成反应 | |
| B. | 苯在50℃~60℃时发生硝化反应,而甲苯在30℃时即可 | |
| C. | 乙烷不能使酸性高锰酸钾溶液褪色,而甲苯能使酸性高锰酸钾溶液褪色 | |
| D. | 乙醇不能与NaHCO3溶液反应,而乙酸能与NaHCO3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质溶液的导电能力一定大于弱电解质溶液的导电能力 | |
| B. | 溶于水能导电的化合物都是电解质 | |
| C. | 25℃时,0.1mol/L的盐酸中氢离子浓度大于0.1mol/L的醋酸中氢离子浓度 | |
| D. | BaSO4属于强电解质,所以其水溶液导电能力很强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石,晶体硅,碳化硅 | B. | CI4>CBr4>CCl4>CH4 | ||
| C. | MgO>CsCl>NaCl | D. | Na>Mg>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O+2NH4Cl=BaCl2•6H2O+2NH3•2H2O+2H2O | |
| B. | Ba(OH)2+H2SO4=BaSO4↓+2H2O | |
| C. | 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ | |
| D. | 8Al+3Fe3O4=4Al2O3+9Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 实验室制乙炔 | 用电石和饱和食盐水反应,将产生的气体再通入到硫酸铜溶液中除杂 |
| B | 检验溴乙烷在氢氧化钠溶液中是否发生水解 | 将溴乙烷和氢氧化钠溶液共热.冷却后,取上层清液,用稀硝酸酸化,再加硝酸银溶液,观察是否产生淡黄色沉淀 |
| C | 除去乙烷中的乙烯气体 | 将混合气体通入到装有高锰酸钾溶液的洗气瓶中 |
| D | 验证氢氧化铁的溶解度小于氢氧化镁 | 将氯化铁溶液加入到氢氧化镁悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com