
用NA表示阿伏加德罗常数,下列说法中正确的是( )
|
| A. | 84g NaHCO3,晶体中含有NACO32﹣ |
|
| B. | 9.2g NO2和N2O4的混合气体中含有的氮原子数为0.2NA |
|
| C. | 标准状况下,11.2L臭氧中含NA个氧原子 |
|
| D. | 78g Na2O2与足量的CO2反应,转移电子数为2NA |
考点:
阿伏加德罗常数.
专题:
阿伏加德罗常数和阿伏加德罗定律.
分析:
A.碳酸氢钠含有钠离子和碳酸氢根离子,不存在碳酸根离子;
B.NO2和N2O4的最简式为NO2,根据最简式计算出混合气体中含有的氮原子数目;
C.标准状况下,11.2L臭氧的物质的量为0.5mol,臭氧分子中含有3个氧原子,含有1.5mol氧原子;
D.过氧化钠中氧元素为﹣1价,78g过氧化钠的物质的量为1mol,1mol过氧化钠完全反应生成0.5mol氧气,转移了1mol电子.
解答:
解:A.84g碳酸氢钠的物质的量为1mol,1mol碳酸氢钠中含有1mol钠离子和1mol碳酸氢根离子,不存在碳酸根离子,故A错误;
B.9.2gNO2和N2O4的混合气体中含有0.2mol最简式NO2,含有0.2mol氮原子,含有的氮原子数为0.2NA,故B正确;
C.标况下11.2L臭氧的物质的量为0.5mol,0.5mol臭氧中含有1.5mol氧原子,含1.5NA个氧原子,故C错误;
D.78g过氧化钠的物质的量为1mol,1mol过氧化钠完全反应生成0.5mol氧气,转移了1mol电子,转移电子数为NA,故D错误;
故选B.
点评:
本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握标准状况下气体摩尔体积的使用条件,明确以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,选项D为易错点,注意过氧化钠中氧元素化合价为﹣1价.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
可逆反应mA(s)+nB(g)⇌eC(g)+fD(g)反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度(T)和不同压强(p)的条件下随时间(t)的变化关系如图所示.下列叙述正确的是()
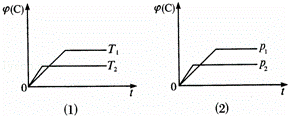
A. 达到平衡后,若使用催化剂,C的体积分数将增大
B. 达到平衡 后,增加A的质量,化学平衡向不移动
后,增加A的质量,化学平衡向不移动
C. 化学方程式中,n>e+f
D. 达到平衡后,若温度升高,化学平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
有下列各组物质:(A)S2和S4 (B)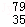 Br和
Br和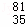 Br (C)CH4和C8H18(D) CH3﹣CH2﹣CH2﹣CH3和
Br (C)CH4和C8H18(D) CH3﹣CH2﹣CH2﹣CH3和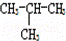
(E)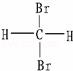 和
和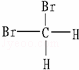
① 组两物质互为同位素
② 组两物质互为同素异形体
③ 组两物质互为同分异构体
④ 组两物质互为同系物
⑤ 组为同一物质.
查看答案和解析>>
科目:高中化学 来源: 题型:
以下说法正确的是( )
A.物质所含元素化合价升高的反应是还原反应
B.在氧化还原反应中,失去电子的元素化合价降低
C.物质中某元素失去电子,则此物质是氧化剂
D.还原剂中必定有某种元素被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
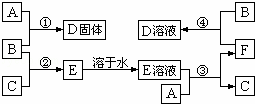
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体.在合适反应条件下,它们可以按下面框图进行反应;又知单质A是当今世界产量最大的金属,E的溶液是无色的.请回答:
(1)A是Fe,B是Cl2,C是H2(请填写化学式);
(2)反应①的化学方程式 ;
(3)反应③的离子方程式 ;
(4)反应④的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组元素的性质递变情况错误的是( )
|
| A. | Li、Be、B原子最外层电子数依次增多 |
|
| B. | P、S、Cl元素最高正价依次升高 |
|
| C. | N、O、F原子半径依次增大 |
|
| D. | Na、K、Rb的金属性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
两种金属混合物共15g,投入足量的盐酸中,充分反应得
1g H2,则原混合物组成中肯定不能为下列的 ( )
A.Mg、Ag B.Fe、Mg C.Al、Cu D.Mg、Al
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com