
| A. | 碘是人体必需微量元素,所以应多吃富含高碘酸的食物 | |
| B. | “血液透析”运用了胶体的性质 | |
| C. | 过氧化钠可作为高空飞行或潜水装置中的供氧剂 | |
| D. | 大力开发太阳能、风能、水能等新能源,减少煤、石油等化石燃料的使用,有利于实现“低碳经济” |
分析 A.碘是人体必需微量元素,适合从食物中补充;
B.血液为胶体分散系,不能透过半透膜;
C.过氧化钠与水或二氧化碳均反应生成氧气;
D.太阳能、风能、水能等新能源的使用,可减少化石能源使用.
解答 解:A.碘为微量元素,需要从食物中补充,可多吃海带等食物,或利用碘盐(含碘酸钾)补充,而不能吃富含高碘酸的食物,故A错误;
B.血液为胶体分散系,不能透过半透膜,则“血液透析”运用了胶体的性质,故B正确;
C.过氧化钠与水或二氧化碳均反应生成氧气,则过氧化钠可作为高空飞行或潜水装置中的供氧剂,故C正确;
D.太阳能、风能、水能等新能源的使用,可减少化石能源使用,减少二氧化碳的排放,则有利于实现“低碳经济”,故D正确;
故选A.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应、化学与生活等为解答的关键,侧重分析与应用能力的考查,注意化学知识在生活中的应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
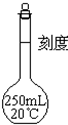 配制250mL 1mol/LNaOH溶液.回答下列问题:
配制250mL 1mol/LNaOH溶液.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 1 | 2 | 3 | 4 |
| Na2S2O3溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 20.01 | 20.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种分子的中心原子的杂化轨道类型不同,NH3为sp2杂化,而CH4是sp3杂化 | |
| B. | NH3分子中氮原子形成3个杂化轨道,CH4分子中碳原子形成4个杂化轨道 | |
| C. | NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强 | |
| D. | 氨气分子是四原子化合物,甲烷为五原子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2 氧化还原反应 | |
| B. | N2+3H2$?_{高温高压}^{催化剂}$2NH3可逆反应 | |
| C. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl 置换反应 | |
| D. | CH2=CH2+Br2→CH2Br-CH2Br 加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔗糖、淀粉、纤维素水解的最终产物都是葡萄糖 | |
| B. | 误服重金属盐,立即服用牛奶或豆浆可解毒 | |
| C. | 油脂、乙酸乙酯都属于酯类,但不是同系物 | |
| D. | 室温下,在水中的溶解度:甘油>苯酚>1-氯丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com