
【题目】如图是SO2(g)和O2(g)反应生成SO3(g)的能量变化示意图,由图可知( )
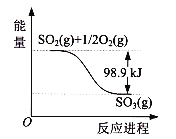
A. 2 SO2(g)+ O2(g)![]() 2 SO3(g) △H= -197.8 kJ/mol
2 SO3(g) △H= -197.8 kJ/mol
B. 2 SO2(g)+ O2(g)![]() 2 SO3(g) △H= +197.8 kJ/mol
2 SO3(g) △H= +197.8 kJ/mol
C. 2 SO2(g)+ O2(g)![]() 2 SO3(g) △H= +98.9 kJ/mol
2 SO3(g) △H= +98.9 kJ/mol
D. 2 SO2(g)+ O2(g)![]() 2 SO3(g) △H= -98.9 kJ/mol
2 SO3(g) △H= -98.9 kJ/mol
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】已知苯乙烯的结构为![]() 。有关该物质的下列说法正确的是( )
。有关该物质的下列说法正确的是( )
A. 该物质在一定条件下和氢气完全加成,加成产物的一溴取代物 6 种
B. 该物质能使溴水和酸性高锰酸钾溶液褪色,褪色原理完全相同
C. 苯乙烯分子的所有原子不可能在同一平面上
D. 除去乙苯中混有的苯乙烯可以通入等量氢气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某元素的价类二维图,其中A为正盐,X是一种强碱,通常条件下Z是无色液体,E的相对分子质量比D大16,各物质的转化关系如图所示。下列说法错误的是
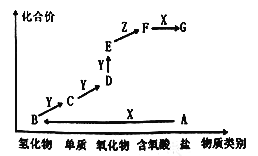
A. A作肥料时不适合与草木灰混合施用
B. 同主族元素的氢化物中B的沸点最低
C. C一般用排水法收集
D. D→E的反应可用于检验D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.从1L1mol/L的氯化钠溶液中取出10mL,其浓度仍是1mol/L
B.制成0.5L10mol/L的盐酸,需要氯化氢气体112L(标准状况)
C.0.5L2mol/L的氯化钡溶液中,钡离子和氯离子总数为3×6.02×1023
D.10g98%硫酸(密度为1.84g/cm3)与10mL18.4mol/L硫酸的浓度是不同的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如图:
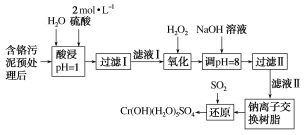
已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
③Cr(OH)(H2O)5SO4是难溶物。
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ | |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9)溶解 |
(1)实验室用18.4mol·L-1的浓硫酸配制480 mL2mol·L-1的硫酸,需要量取浓硫酸___mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需____。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:_____。
(3)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O72-转化为___(填微粒的化学式)。
(4)钠离子交换树脂的反应原理为Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有___。
(5)写出上述流程中用SO2进行还原时发生反应的离子方程式:__。
(6)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN-的浓度,可用标准AgNO3溶液滴定待测液,已知:
银盐性质 | AgCl | AgI | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 黄 | 白 | 砖红 | 白 |
Ksp | 1.8×10-10 | 8.3×10-17 | 1.2×10-16 | 3.5×10-11 | 1.0×10-12 |
滴定时可选为滴定指示剂的是___(填编号),滴定终点的现象是___。
A.NaCl B.K2CrO4 C.KI D.NaCN
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中通常加热无水乙醇与浓硫酸的混合物的方法制取乙烯,在具体的化学实验中常因加热的温度过高导致副反应发生而使乙烯气体中混有二氧化硫气体,有人设计下列实验以确认乙烯气体中混有二氧化硫气体。请回答下列问题:
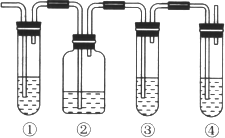
(1) 图中①和④的容器内盛放的化学试剂分别是(填写代号)
①_____________________、④_________________________。
A.品红溶液 B.烧碱溶液 C.浓硫酸 D.酸性高锰酸钾溶液
(2)能说明二氧化硫气体存在的现象是____________________________________________。
(3)使用装置②的目的是______________________;使用装置③的目的是__________________。
(4)确认乙烯气体存在的现象是_____________________________________________________。
(5)确认乙烯气体的存在还可用溴水,请写出乙烯与溴水反应的方程式_________________;其反应类为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制0.50 mol·L-1NaCl溶液480 mL。按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(带砝码、最小砝码为5 g)、药匙、烧杯、________、________、________以及等质量的两片滤纸。
(2)计算。配制该溶液需取NaCl晶体________g。
(3)称量。
①天平调平之后,应将天平的游码调至某个位置,请在如图中用一根竖线标出游码左边缘所处的位置:________
![]()
②称量过程中NaCl晶体应放于天平的________(填“左盘”或“右盘”)。
③称量完毕,将药品倒入烧杯中。
(4)溶解、冷却。该步实验中需要使用玻璃棒,目的是___________________。
(5)转移、洗涤。在转移时应使用玻璃棒引流,需要洗涤烧杯2~3次是为了________________。
(6)定容。向容量瓶中加水至液面接近刻度线________处,改用________加水,使溶液凹液面与刻度线相切。
(7)摇匀、装瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Na表示阿伏加德罗常数的值,下列叙述错误的是
A.含有NA个氢原子的氢气在标准状况下的体积约为11.2L
B.25℃,1.01×105Pa,64gSO2中含有的原子数为3Na
C.在常温常压下,35.5g Cl2含有的分子数为0.5Na
D.标准状况下,11.2LH2O含有的分子数为0.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com