
| A、蛋白质、纤维素、蔗糖、PVC、淀粉都是高分子化合物 |
| B、氢键在形成蛋白质二级结构和DNA双螺旋结构中起关键作用 |
| C、加热能杀死流感病毒是因为病毒的蛋白质受热变性 |
| D、合金材料中可能含有非金属元素 |


科目:高中化学 来源: 题型:
A、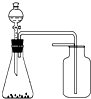 选择合适的试剂,装置可分别制取少量CO2、NO和O2 |
B、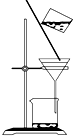 洗涤沉淀时(如图),向漏斗中加适量水,搅拌并滤干 |
| C、制备乙酸乙酯时,向乙醇中缓慢加入浓硫酸和冰醋酸 |
| D、用广泛pH试纸测得0.10 mol?L-1 NH4Cl溶液的pH=5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 可经三步反应制取
可经三步反应制取  ,发生反应的类型依次是( )
,发生反应的类型依次是( )| A、水解反应、加成反应、氧化反应 |
| B、加成反应、水解反应、氧化反应 |
| C、水解反应、氧化反应、加成反应 |
| D、加成反应、氧化反应、水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、A的分子式为:C14H13O5N2 |
| B、A可以发生水解反应、中和反应、加成反应、消去反应 |
| C、A物质完全水解的产物中,一定含有醇类 |
| D、在一定条件下,1molA最多能与1L 2mol?L-1NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钢铁在海水中比在河水中更易腐蚀,主要原因是海水含盐量高于河水 |
| B、NaFeO4自身处理水的原理与明矾和漂白粉共同处理水的原理相同 |
| C、高温或日常用的消毒剂可使H7N9型禽流感病毒蛋白质变性 |
| D、“雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物无关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com