
����Ŀ�����⻯�ƣ�NaAlH4�����л��ϳɵ���Ҫ��ԭ����ij�����龭�������Ϻ���ƺϳ����⻯�Ƶ�������ͼ��ʾ��

��֪����AlCl3��NaH��NaAlH4��ˮ����Ѹ�ٷ�����Ӧ��
�ڳ����£����ø�����ء�����ء��ظ���ء�������Ƶ���Ũ���ᷴӦ��ȡ������
��1�����⻯����ˮ�������ҷ�Ӧ���������ܷ�����ը����ԭ����_______
д�����⻯����ˮ��Ӧ�Ļ�ѧ����ʽ_________
��2����ͬѧ���ʵ���Ʊ���ˮ�Ȼ�����װ����ͼ��ʾ��
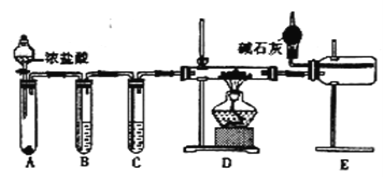
��װ��E�и���ܵ�������_______________________��
�ڵ�ȼװ��D���ƾ���֮ǰ �����ž�װ���ڵĿ����������������______��
��3����ͬѧ������ͬѧ��Ƶ�װ�ú���Ϊֻ�ı�A��B��D�е��Լ��Ϳ����ü�ͬѧ��Ƶ�װ���Ʊ�NaH��
���Թ�B�е��Լ���Ϊ____________________��
�����������������Ƶõ�NaH��Ʒ�п��ܺ��е�������_______��
��4����ͬѧ�������3��װ�òⶨ���⻯����Ʒ�Ĵ���(�������ʲ����뷴Ӧ)��
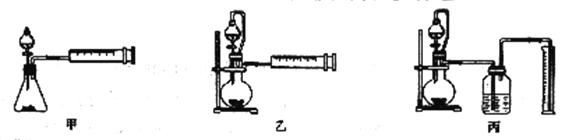
���ײ����ԡ�ȷ�ԽǶȿ�����ѡװ��___������ж����⻯����ˮ��ȫ��Ӧ��___
���𰸡� ��Ӧ�ų���������ʹ���ɵ�H2Ѹ�����Ͷ���ը NaAlH4+2H2O=NaAlO2+4H2�� ����ʣ�����������������е�ˮ��������D�� �Ƚ�װ��A�еķ�Һ©������Ӧһ��ʱ�䣬ʹD�в����ܳ�������ɫ���� NaOH��Һ Na2O2����Na�� �� �������ζ�ȡ��H2������
����������1�����⻯����ˮ�������ҷ�Ӧ����ƫ�����ƺ��������䷴Ӧ�Ļ�ѧ����ʽΪNaAlH4+2H2O��NaAlO2+4H2������Ӧ�ų���������ʹ���ɵ�H2Ѹ�����Ͷ���ը����2����������Ⱦ������ͬʱ���Ȼ�������ˮ��Ӧ��֪��Eװ���еļ�ʯ������ʣ�����������������е�ˮ��������D�У��ڵ�ȼװ��D���ƾ���֮ǰ���Ƚ�װ��A�еķ�Һ©������Ӧһ��ʱ�䣬ʹD�в����ܳ�������ɫ�壬�ž�װ���ڵĿ�������3���ٽ����ƺ�����֮�仯�Ͽ��Ե�NaH��A���ɽ����������Ʊ����������ɵ��������Ȼ���Ӧ�ü����Լ���ȥ�����������ƣ���B���Լ�ΪNaOH��Һ���ڽ����ƺ����������»�����������������Լ�������Na����4���ɷ�Ӧԭ���ã��ⶨ���⻯����Ʒ�Ĵ��ȼ�ͨ���ⶨ���⻯����ˮ��Ӧ���ɵ����������������⻯�Ƶ������Ӷ������䴿�ȣ����ԴӼ�Լ�ԡ�ȷ�Կ��ǣ�װ�ü�û��ʹ�ú�ѹ©�����������������C��D������ˮ���ռ����������ڵ����л��в��������²���������������˵ķ������ң�ͨ���������ζ��������������ȣ�˵�����⻯����ˮ��ȫ��Ӧ��


 ͬ����ϰ���ϴ�ѧ������ϵ�д�
ͬ����ϰ���ϴ�ѧ������ϵ�д� ͬ����ϰ����ʦ����ѧ������ϵ�д�
ͬ����ϰ����ʦ����ѧ������ϵ�д� ����ϰ�⽭��ϵ�д�
����ϰ�⽭��ϵ�д� ѧ���쳵��������������������ϵ�д�
ѧ���쳵��������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���绯ѧ�ڻ�ѧ��ҵ���Ź㷺��Ӧ�ã�
��1����ҵұ�����Ļ�ѧ����ʽ��___________________________��
��2����ҵ���������ص���Һ�к���ijЩ����������ʣ��������ӽ�����Ĥ������ᴿ��������װ�������ӽ���Ĥ��ֻ����������ͨ�������乤��ԭ����ͼ��ʾ��
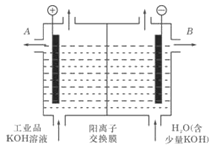
�ٸõ��۵�������Ӧʽ��________________________��
�ڳ�ȥ���ʺ������������Һ��Һ�����__________����д��A����B����������
��3���״�ȼ�ϵ��������ṹ������ת���ʸߡ��Ի�������Ⱦ������Ϊ������Դ�����Ʒ��Խ��Խ�ܵ���ע���乤��ԭ������ͼ�����ӽ���Ĥ�����������Һ��Ϊ1L 1.5 mol/L H2SO4 ��Һ��
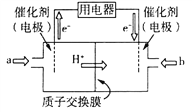
��ͨ������a�ĵ缫�ǵ�ص�________�������������������缫��ӦʽΪ___________________________________��
�ڵ��������2 mol e������ת��ʱ������������Һ��������ֵΪ_________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧϰ���о���ѧ��һ�ֵ���Ҫ���������з������������ ��
A. KOH��Na2CO3�����ڼ� B. H2SO4��HNO3��������
C. K2CO3��K2O�������� D. Na2O��Na2SiO3������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ�����ӵ�������ֵ������˵����ȷ����
A. ��״���£�22.4 L����ķ�����ԼΪNA
B. 1 L 0.1 mol��L��l��Na2S��Һ��S2����HS��������Ϊ0.1NA
C. 4.0 g H![]() O��D2O�Ļ����������������Ϊ2NA
O��D2O�Ļ����������������Ϊ2NA
D. 50 mL 12 mol��L��1����������MnO2���ȣ�ת�Ƶĵ�����Ϊ0.3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����FeI2��FeBr2�Ļ����Һ��ͨ��������������Һ��ijЩ���ӵ����ʵ����仯��ͼ��ʾ����֪��2Fe2++Br2�T2Fe3++2Br����2Fe3++2I���T2Fe2++I2 �� �������й�˵���в���ȷ���ǣ� �� 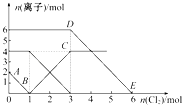
A.��ԭ�ԣ�I����Fe2+��Br��
B.�߶�AB��ʾFe2+����������
C.�߶�BC��ʾ����4 mol Fe3+
D.ԭ��Һ��n��Br����=6 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.��ˮ��pH��һ������7
B.ԭ��ص������нϻ��õĽ���һ��Ϊ����
C.������Һ�ĵ�������һ���ȴ�����Һ�ĵ�������ǿ
D.������һ�����淴Ӧ���¶ȣ��÷�Ӧ��ѧƽ�ⳣ��һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵���в���ȷ����
A. ij�ض�ʱ�Ļ����Һ��C(H+) =![]() mol��L-1��˵������Һ������(KWΪ���¶�ʱˮ�����ӻ�������
mol��L-1��˵������Һ������(KWΪ���¶�ʱˮ�����ӻ�������
B. �����£���ˮ�������c(H+)=10-12mol��L-1����Һ��PH����Ϊ2��12
C. ��֪Ksp(AgCl)=1.56��10-10��Ksp(Ag2CrO4)=9.0��10-12������Cl-��CrO42-��Ũ�Ⱦ�Ϊ0.010mol��L-1��Һ����μ���0.010mol��L-1��AgNO3��Һʱ��Cl-�Ȳ�������
D. ������PH=7��CH3COOH��CH3COONa�����Һ�У�c(Na+)=c(CH3COO-)+c(CH3COOH)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��̬��0.5mol����1molHCl�ӳɣ�ת��Ϊ�ȴ��������ӳɺ��������ϵ���ԭ���ֿɱ�3mol�ȷ�����ȫȡ��������������� �� ��
A. CH��CHB. CH��C��CH3
C. CH3��C��C��CH3D. CH2=CH��CH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����11.2g��Mg��Cu�������ȫ�ܽ��������������У��ռ���Ӧ����������x���ٶ�����������ȫ���ݳ���������������Һ�м���������NaOH��Һ������21.4g���������������ƶ�����x�ijɷֿ�����
A. 0.3mol NO2��0.3mol NO
B. 0.2mol NO2��0.1mol N2O4
C. 0.6mol NO
D. 0.1mol NO��0.2mol NO2��0.05mol N2O4
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com