
 $\stackrel{KMnO_{2}H+}{→}$
$\stackrel{KMnO_{2}H+}{→}$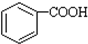
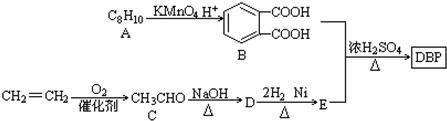
 (-R1、-R2表示氢原子或烃基)
(-R1、-R2表示氢原子或烃基)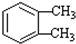 ,D→E的反应类型加成(或还原)反应.
,D→E的反应类型加成(或还原)反应.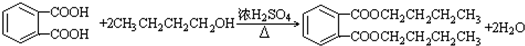 .
. .
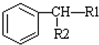
.分析 由B可知A应为 ,甲基被氧化为羧基,由信息②可知D为CH3CH=CHCHO,则E为CH3CH2CH2CH2OH,B与E的反应为酯化反应,DBP为
,甲基被氧化为羧基,由信息②可知D为CH3CH=CHCHO,则E为CH3CH2CH2CH2OH,B与E的反应为酯化反应,DBP为 ,根据有机物的结构和性质结合题目要求可解答该题.
,根据有机物的结构和性质结合题目要求可解答该题.
解答 解:由B可知A应为 ,甲基被氧化为羧基,由信息②可知D为CH3CH=CHCHO,则E为CH3CH2CH2CH2OH,B与E的反应为酯化反应,DBP为
,甲基被氧化为羧基,由信息②可知D为CH3CH=CHCHO,则E为CH3CH2CH2CH2OH,B与E的反应为酯化反应,DBP为 ,
,
(1)由以上分析可知A为 ,D为CH3CH=CHCHO,与氢气发生加成反应生成E,也为还原反应,
,D为CH3CH=CHCHO,与氢气发生加成反应生成E,也为还原反应,
故答案为: ;加成(或还原)反应;
;加成(或还原)反应;
(2)DBP为 ,分子式为C16H22O4,D为CH3CH=CHCHO,
,分子式为C16H22O4,D为CH3CH=CHCHO,
故答案为:C16H22O4; CH3CH=CHCHO;
(3)E为CH3CH2CH2CH2OH,与邻苯二甲酸发生酯化反应,反应的方程式为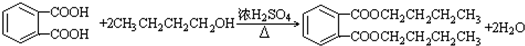 ,
,
故答案为: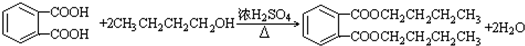 ;
;
(4)B对应的同分异构体中①能和NaHCO3溶液反应生成CO2,说明含有-COOH,②能发生银镜反应,说明含有-CHO,
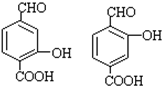
③能使 FeCl3溶液发生显色反应,说明不含有酚羟基,④苯环上含碳基团处于对位,则对应的结构简式有 ,
,
故答案为: .
.
点评 本题考查有机物的合成与推断,题目难度中等,注意把握有机物官能团的性质,为解答该题的关键,易错点为(4),注意把握同分异构体的性质和结构特点.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 在蒸馏烧瓶中盛约$\frac{1}{3}$体积的自来水,并放入几粒沸石 | |
| B. | 将温度计水银球与支管口保持水平 | |
| C. | 冷水从冷凝管下口出,上口入 | |
| D. | 收集到的液体取少量滴入硝酸银和稀硝酸,无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙CaCO3熟石灰 | B. | 氢氧化钠NaOH纯碱 | ||
| C. | 碳酸钠Na2CO3苏打 | D. | 碳酸氢钠NaHCO3苏打 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a为电源的负极 | |
| B. | 负极反应方程式为:Ag-e-+Cl-═AgCl | |
| C. | 阴极的电极反应式为2HSO3-+2H++2e-═S2O42-+2H2O | |
| D. | 当电路中转移电子的物质的量为5×10-5 mol时,进入传感器的SO2为1.12 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH2-CH3 | B. | (CH3)2CHCl | C. | (CH3)2CHOH | D. | (CH3)2CHBr |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com