
【题目】在Fe2+、Na、H+、SO2微粒中,只有氧化性的是:;既有氧化性又有还原性的是: .
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y
的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是
A. 氢化物的稳定性:X >W
B. 离子半径:X >Y
C. 氧化物水化物的酸性W > Z
D. Z与X属于同一主族,与Y属于同一周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A. 可用电渗析法进行海水淡化
B. 乙烯与氧气在银催化作用下只生成环氧乙烷(![]() ),该反应符合绿色化学原子经济性要求
),该反应符合绿色化学原子经济性要求
C. 向某溶液中滴入盐酸酸化的氯化钡溶液出现白色沉淀,证明该溶液中一定含有SO42-
D. 酒是陈的香,原因之一是储存过程中生成了有香味的酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知pOH=-lgc(OH)。t℃时,往50mL0.1mol/LMOH溶液滴加0.1mol/L盐酸,溶液pH、pOH随滴入盐酸体积的变化如下图所示,以下说法正确的是
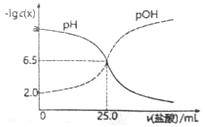
A. a=12
B. 盐酸与MOH溶液恰好中和时溶液pH=6.5
C. 滴人盐酸体积达26.0mL时,溶液中微粒浓度c(Cl-)>c(H+)>c(M+)>c(MOH)>c(OH-)
D. t℃时,MOH的Kb>1.0×10-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373K时,把0.5molN2O4气体通入体积为5L(恒容)的真空密闭容器中,立即出现红棕色。反应进行到60s时体系达到平衡,此时容器内压强为反应前的1.6倍。下列说法不正确的是:
A. 平衡时,N2O4的转化率为60%
B. 平衡时,体系内NO2为0.12mol·L-1
C. 其它条件不变,平衡后再往该密闭容器中通入0.5molN2O4气体,重新达到平衡时N2O4的体积百分数减少
D. 其它条件不变,平衡后再往该密闭容器中通入1molN2O4气体,重新达到平衡时该反应平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请根据原电池原理回答问题:
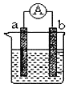
(1)若电极a为Zn、电极b为Cu、电解质溶液为稀硫酸,该装置工作时,SO42向_____极(填a或b)移动,正极的电极反应式为_______________________________。
(2)若电极a为Mg、电极b为Al、电解质溶液为氢氧化钠溶液,该原电池工作时,电子从_____极(填a或b)流出。一段时间后,若反应转移3NA个电子,则理论上消耗Al的质量是________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得常温下0.1mol/L某一元酸HA溶液的pH≠1,0.1mol/L某一元碱BOH溶液里![]() 。将此两种溶液等体积混合后,所得溶液呈的各离子浓度间关系正确的是( )
。将此两种溶液等体积混合后,所得溶液呈的各离子浓度间关系正确的是( )
A.c (A-)>c (B+)>c (H+)>c (OH-)
B.c (B+)=c (A-)>c (H+)=c (OH-)
C.c (OH-)- c (H+)=c(HA)
D.c (B+)+ c (H+)=c (A-)+c (OH-) + c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活生产、可持续发展密切相关。下列说法中正确的是
A.14C可用于文物年代的鉴定,14C和12C互为同素异形体
B.为了消除碘缺乏病,在食用盐中加入一定量的碘单质
C.高纯度的SiO2可以制成光电池,将光能直接转化为电能,
D.Fe2O3是一种红棕色粉末,常用作红色油漆和涂料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素能够形成多种化合物。请回答下列问题:
(1)联氨(N2H4)常温下为液态,在空气中迅速完全燃烧生成N2,同时放出大量热,可作导弹、宇宙飞船、火箭的燃料。
已知:H2(g)+1/2O2(g)==H2O(l);△H1=-285.8kJ/mol
N2(g)+2H2(g)=N2H4(l);△H2=+50.6kJ/mol
则N2H4(l)在空气燃烧生成液态水的热化学方程式为_____________。
(2)工业上利用氨气生产氢氰酸(HCN)的反应为CH4(g)+NH3(g)![]() HCN(g)+3H2(g) △H>0。
HCN(g)+3H2(g) △H>0。
①一定温度下,向2L恒容容器中充入1mol CH4(g)和2mol NH3(g)发生上述反应,4min达到平衡时,测得CH4的转化率为66.67%。0~4min內,用H2表示的该反应速率v(H2)=_____。
保持温度和容积不变,再句平衡后的容器中充入2molNH3和2molH2,此时v正___v逆(选填“>”“<”或“=”)。
②平衡体系中HCN的物质的量(n)随某物理量变化曲线如图所示(图中x、L分别表示温度或压强)。
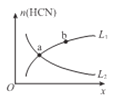
若x为温度,则曲线,____(选填“L1”或“L2”)能正确表示n (HCN) 与温度的关系;
若x为压强,则曲线____(选填“L1”或“L2”)能正确表示n HCN)与压强的关系。
(3)NH3能够形成Ag(NH3)2+。
①溶液中存在Ag+ (aq)+2NH3 (aq)==Ag( NH3)2+(aq )时,其平衡常数的表达式为K稳=_______。
②常温下,K稳[Ag(NH3)2+]=1.10×107,反应AgCl (s)+2NH3 (aq)![]() Ag( NH3)2+(aq) +Cl-(aq)的化学平衡常数K=1.936×10-3,则Ksp(AgCl)=_____。
Ag( NH3)2+(aq) +Cl-(aq)的化学平衡常数K=1.936×10-3,则Ksp(AgCl)=_____。
(4)硫氧化物和氮氧化物是常见的大气污染物,利用如图所示发置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。
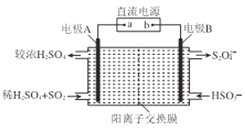
①电极A的电极反应式为______________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体。同时有SO32-生成。该反应离子方程式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com