
(16分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
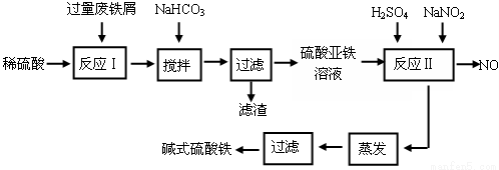
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在 范围内,使溶液中的 沉淀(写离子符号)。
(2)反应Ⅱ中加入NaNO2的目的是 ,发生反应的离子方程式为 。
(3)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为 。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为 。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(1)4.4~7.5 (2分) Al3+ (2分)
(2)氧化Fe2+(2分) 2H+ + Fe2++ NO2- = Fe3+ + NO↑ + H2O (3分)
(3)2 mol (2分) (4)2Fe(OH)2+ +2H2O Fe2(OH)42+ + 2H+ (3分) (5)D (2分)
Fe2(OH)42+ + 2H+ (3分) (5)D (2分)
【解析】
试题分析:(1)制备硫酸亚铁,应与硫酸铝分离,应调节溶液pH使溶液中的Al3+生成Al(OH)3沉淀,同时要避免生成应Fe(OH)2沉淀,控制pH在4.4≤pH<7.5之间;
(2)亚硝酸盐具有氧化性,在酸性条件下能把亚铁离子氧化生成铁离子,反应的离子方程式为2H+ + Fe2++ NO2- =Fe3+ + NO↑ + H2O;
(3)氧气的物质的量是11.2L÷22.4L/mol=0.5mol,则得到电子0.5mol×4=2mol,1molNaNO2被还原生成NO,化合价由+3价降低到+2价,得到1mol电子,则需要2molNaNO2;
(4)[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子,根据电荷守恒和质量守恒可写出反应的离子方程式为2Fe(OH)2+ +2H2O Fe2(OH)42+ + 2H+;
Fe2(OH)42+ + 2H+;
(5)A、氯水可以氧化亚铁离子为铁离子,溶液颜色变化不明显,不能检验亚铁离子,故A不符合;B、KSCN溶液和亚铁离子不反应,无现象发生,故B不符合;C、NaOH溶液加入和铁离子反应生成红褐色沉淀不能检验是否存在亚铁离子,故C不符合;D、酸性KMnO4溶液氧化亚铁离子高锰酸钾溶液褪色,故D符合,答案选D。
考点:考查物质制备工艺流程图的有关判断与计算


 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、太阳能电池板中有高纯硅单质,光导纤维的主要成分也是硅 | B、分类方法、统计方法、定量研究、实验方法和模型化方法等是化学研究的常用方法 | C、核磁共振谱、红外光谱、紫外光谱和质谱法的综合运用,可用于分析有机物的结构 | D、绿色荧光蛋白在研究癌症发病机制的过程中应用突出,在酸性或碱性条件下可能会失去发光功能 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省海珠等四区高三联考理综化学试卷(解析版) 题型:实验题
(14分)二氯化锡是一种重要的电镀原料,又称氯化亚锡。分子式为SnCl2,其沸点为623℃,在水溶液中以SnCl2·2H2O的形式析出。锡的另一种氯化物SnCl4的沸点为114℃。某锡花中(主要成分为锡)含有杂质钡、锑、铜、铅等金属。从锡花中制备二氯化锡晶体工艺如下:
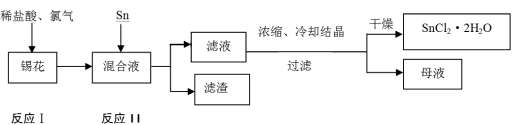
(1)滤渣成分为 (用化学式表示)。
(2)经过氯化后的锡主要以SnCl4的形式存在混合液中。写出锡与SnCl4反应的化学方程式 。
(3)反应Ⅰ进行反应时,加热反应器使反应液温度升高至600C,开始通入Cl2,随着反应的进行,反应所放出的热量使溶液的温度提高,此时需保持反应温度在80℃~90℃之间,不宜过高。请解释
①温度不宜过高的原因是 ;
②开始通入氯气时,气体流量不宜过大,随反应的进行逐渐加大氯气的通入量,此操作的目的是 。
(4)母液中含有的离子有H+、OH-、 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省海珠等四区高三联考理综化学试卷(解析版) 题型:选择题
下列说法正确的是
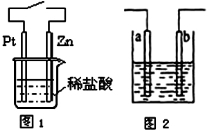
A.与铜质水龙头连接处的钢质水管不易发生腐蚀
B.用电解法提取氯化铜废液中的铜,可以用碳棒连接电源的正极,另一电极用铜片
C.图1中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图2所示装置可发生反应的离子方程式为Zn + 2H+=Zn2++ H2↑,且a、b电极不可能是同种材料
查看答案和解析>>
科目:高中化学 来源:2015届广东省揭阳市高三上学期第一次阶段考试理综试卷(解析版) 题型:选择题
对于等物质的量浓度的Na2CO3和NaHCO3溶液,下列说法不正确的是
A.分别升高温度,两种溶液的pH均减小
B.相同温度下两种溶液的pH:Na2CO3> NaHCO3
C.分别加入少量NaOH,两溶液中c(CO32-)均增大
D.两溶液均存在c(Na+) + c(H+)=c(OH-) + c(HCO3-) + 2c(CO32-)
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高三第二次调研考试化学试卷(解析版) 题型:实验题
(16分) 硅孔雀石是一种含铜矿石,含铜形态为CuCO3·Cu(OH)2和CuSiO3·2H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质。以其为原料制取硫酸铜的工艺流程如图:
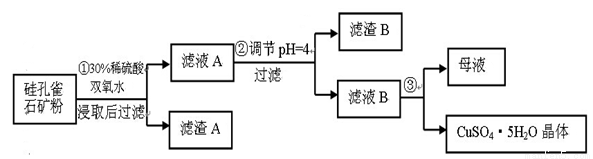
(1)完成步骤①中稀硫酸与CuSiO3·2H2O反应的化学方程式:
CuSiO3·2H2O+H2SO4=CuSO4 +_______+H2O;双氧水的作用是____ 。
(2)步骤②调节溶液pH,可以选用的试剂是______。
A. CuO B.Fe2O3 C.Al2O3 D.Cu(OH)2
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
步骤②中,调节pH=4时,所得滤渣B的成分的化学式为 ,滤液B中除Cu2+外, 还含有的金属阳离子是 。
(4)将滤液B通过 、 ,过滤等操作可得到硫酸铜晶体。
(5)测定硫酸铜晶体结晶水的含量时,应将其放入______中灼烧。加热失水后,若在空气中冷却称量,测定结果____(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三9月第二次月考化学试卷(解析版) 题型:选择题
下列实验能达到目的的是
A.只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液
B.将NH4Cl溶液蒸干制备NH4Cl固体
C.用萃取分液的方法除去酒精中的水
D.用可见光束照射以区别溶液和胶体
查看答案和解析>>
科目:高中化学 来源:2015届广东省佛山市高三9月考化学试卷(解析版) 题型:实验题
(12分)现有一块铁碳合金,某化学兴趣小组为了测定合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置进行实验(夹持仪器已省略),请你参与此项活动并回答相应的问题。
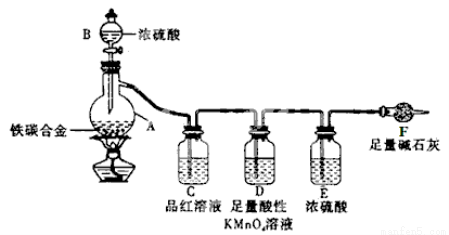
(1)以下有关合金的说法,正确的是 (填写字母)
A.铁碳合金的熔点高于纯铁和碳
B.铁碳合金的熔点介于纯铁和碳之间
C.铁碳合金的硬度大于纯铁
D.其他条件相同时,铁碳合金的耐腐蚀性强于纯铁
(2)按图示连接好装置,检验气密性,加入药品,称量F的质量,将m g合金样品放入A中,再通过B加入过量的浓硫酸。未点燃酒精灯前,A中无明显现象,其原因是: 。
(3)点燃酒精灯,反应一段时间后,C、D中可观察到明显的现象。写出合金样品在A中反应的化学方程式_______ , _____________________________。
(4)C中的现象是_______________________,D中足量酸性KMnO4 溶液的作用是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com