
分析 设出C2H2和H2的物质的量,然后根据质量、标况下的气体体积列式计算,根据计算结果及n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$进行计算.
解答 解:设C2H2和H2的物质的量分别为x、y,
则:$\left\{\begin{array}{l}{x+y=\frac{6.72}{22.4}}\\{26x+2y=3.0}\end{array}\right.$,解得:$\left\{\begin{array}{l}{x=0.1mol}\\{y=0.2mol}\end{array}\right.$,
此混合气体的C2H2和H2的物质的量之比=0.1mol:0.2mol=1:2;
混合气体的平均摩尔质量为:$\frac{3.0g}{0.1mol+0.2mol}$=10mol/L;
C和H原子的个数之比等于C、H原子的物质的量之比=(0.1mol×2):(0.1mol×2+0.2mol×2)=1:3;
混合气体中H2的质量分数为:$\frac{2g/mol×0.2mol}{3.0g}$×100%≈13.3%,
故答案为:1:2;10g/mol;1:3;13.3%.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与摩尔质量、阿伏伽德罗常数之间的关系即可解答,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 洗涤的目的一般是除去沉淀或晶体表面可溶性的杂质,以提高固体的纯度 | |
| B. | 洗涤的操作是:向过滤器里的固体直接注入洗涤剂浸没固体,待洗涤剂自然流下即可 | |
| C. | 洗涤的试剂根据需要一般可选用蒸馏水、冰水、乙醇或该物质的饱和溶液 | |
| D. | 是否洗净的检验:取最后一次洗涤液,鉴别含有形成相应沉淀的该溶液中的离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在水溶液中或熔融状态下均不导电的化合物叫非电解质 | |
| B. | 电解质、非电解质都指化合物而言,单质不属于此范畴 | |
| C. | 电解质在水中一定能导电,在水中导电的化合物一定是电解质 | |
| D. | 纯水的导电性很差,所以水不是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
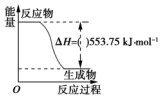 (1)运动会中的火炬一般采用丙烷(C3H8)为燃料.丙烷热值较高,污染较小,是一种优良的燃料.试回答下列问题:
(1)运动会中的火炬一般采用丙烷(C3H8)为燃料.丙烷热值较高,污染较小,是一种优良的燃料.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
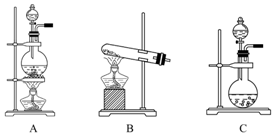 如表是实验室制备气体的有关内容:
如表是实验室制备气体的有关内容:| 编号 | 实验内容 | 实验原理 | 发生装置 |
| ① | 制氧气 | H2O2-→O2 | |
| ② | 制氨气 | NH4Cl-→NH3 | |
| ③ | 制氯气 | HCl-→Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com