
| A. | 由水电离出的c(H )═10-13mol/L 溶液:Mg2+、Cu2+、SO42-、NO3- | |
| B. | 无色溶液中:Na+、NH4+、Cl-、S2- | |
| C. | 高锰酸钾溶液:Fe3+、H+、SO42-、C2H5OH | |
| D. | 中性溶液中:Fe3+、K+、Cl-、SO42- |
分析 A.该溶液中存在大量氢离子或氢氧根离子,四种离子之间不反应,都不与氢离子反应;
B.铵根离子与硫离子发生双水解反应;
C.高锰酸钾在酸性条件下具有强氧化性,能够氧化乙醇;
D.铁离子只能存在于中性溶液中.
解答 解:A.由水电离出的c(H )═10-13mol/L 溶液中存在大量氢离子或氢氧根离子,Mg2+、Cu2+、SO42-、NO3-之间不反应,都不与氢离子反应,在酸性溶液中能够大量共存,故A正确;
B.NH4+、S2-之间发生双水解反应,在溶液中不能大量共存,故B错误;
C.酸性高锰酸钾能够氧化C2H5OH,在溶液中不能大量共存,故C错误;
D.Fe3+只能存在于中性溶液中,在中性溶液中不可能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


科目:高中化学 来源: 题型:解答题
 1mol化合物Ⅰ能与4molH2发生完全加成反应
1mol化合物Ⅰ能与4molH2发生完全加成反应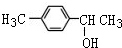 或
或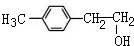 (写1种即可);由Ⅲ生成Ⅰ的反应条件为NaOH的乙醇溶液,加热.
(写1种即可);由Ⅲ生成Ⅰ的反应条件为NaOH的乙醇溶液,加热.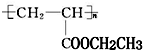 可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3;利用类似反应①的方法,以乙烯和乙醇为有机物原料合成该单体,该反应的化学方程式为2CH2=CH2+2CH3CH2OH+2CO+O2$\stackrel{一定条件下}{→}$2CH2=CH-COOCH2CH3+2H2O.
可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3;利用类似反应①的方法,以乙烯和乙醇为有机物原料合成该单体,该反应的化学方程式为2CH2=CH2+2CH3CH2OH+2CO+O2$\stackrel{一定条件下}{→}$2CH2=CH-COOCH2CH3+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取在空气中久置的碳酸钠晶体143.0g | |
| B. | 定容时,仰视观察刻度线 | |
| C. | 转移溶液时,用于溶解碳酸钠晶体的烧杯没有洗涤 | |
| D. | 定容后,将容量瓶震荡摇匀,静置时发现液面低于刻度线,于是又加少量水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “天宫”一号中使用的碳纤维,是一种新型无机非金属材料 | |
| B. | 氢氧化铁溶胶、雾、食盐水均能观察到丁达尔效应 | |
| C. | 盐酸、氢氧化铁胶体、汽油、橡胶均为混合物 | |
| D. | 生成盐和水的反应不一定是中和反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
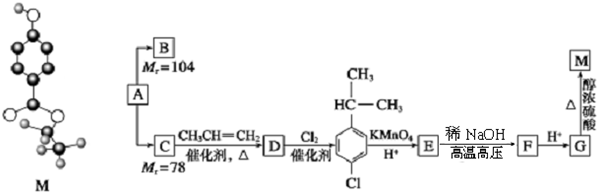

 ,B与等物质的量Br2作用时可能有2种产物.
,B与等物质的量Br2作用时可能有2种产物.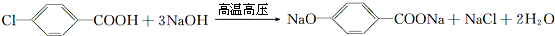 .
.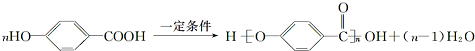 .
.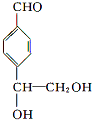 等.
等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光化学烟雾与大量排放碳氢化合物和氮氧化合物有关 | |
| B. | 将草木灰和硫酸铵混合施用,肥效更高 | |
| C. | 棉花的主要成分是纤维素,石英玻璃、陶瓷和水泥均属于硅酸盐产品 | |
| D. | 硫酸工业尾气未经处理就直接排放,将直接导致“温室效应” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
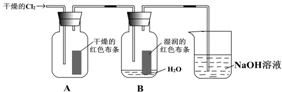 某同学设计了有关氯气的实验:
某同学设计了有关氯气的实验: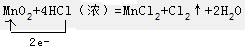
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
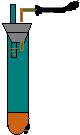 如图所示,向小试管中加入约3毫升饱和CuSO4溶液,再用胶头滴管沿试管壁小心地缓慢滴入 2 毫升浓H2SO4,静止片刻,请将观察到的现象填在空白处:
如图所示,向小试管中加入约3毫升饱和CuSO4溶液,再用胶头滴管沿试管壁小心地缓慢滴入 2 毫升浓H2SO4,静止片刻,请将观察到的现象填在空白处:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察如图,然后回答问题.
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察如图,然后回答问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com