
| A. | 无色溶液:Al3+、NH4+、Cl-、HCO3- | |
| B. | 使紫色石蕊试纸变红色的溶液:Cl-、NO3-、Fe2+、K+ | |
| C. | 常温下,pH=13的溶液:K+、CO32-、Na+ | |
| D. | c(H+)=0.1mol/L的溶液:CO32-、Na+、HCO3-、Cl- |
分析 A.Al3+、HCO3-相互促进水解;
B.使紫色石蕊试纸变红色的溶液,显酸性,离子之间发生氧化还原反应;
C.常温下,pH=13的溶液,显碱性;
D.c(H+)=0.1mol/L的溶液,显酸性.
解答 解:A.Al3+、HCO3-相互促进水解,不能大量共存,故A不选;
B.使紫色石蕊试纸变红色的溶液,显酸性,NO3-、Fe2+、H+发生氧化还原反应,不能共存,故B不选;
C.常温下,pH=13的溶液,显碱性,该组离子之间不反应,可大量共存,故C选;
D.c(H+)=0.1mol/L的溶液,显酸性,不能大量存在CO32-、HCO3-,故D不选;
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、水解与氧化还原反应的判断,题目难度不大.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:多选题
| A. | 中和时所需NaOH的量 | B. | 电离的程度 | ||
| C. | H+的物质的量浓度 | D. | H+的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去N2中的少量O2,可通过灼热的Cu网后,收集气体 | |
| B. | 除去FeCl3溶液中Fe(OH)3沉淀可以过滤 | |
| C. | 除去乙醇中的少量NaCl,可用蒸馏的方法 | |
| D. | 重结晶不能用于提纯物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| B. | 蒸馏操作时,应使温度计水银球插入蒸馏烧瓶内的液面以下 | |
| C. | 用蒸发的方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
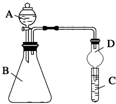 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制的氯水在光照条件下颜色变浅 | |
| B. | 实验室用排饱和食盐水法收集氯气 | |
| C. | 合成氨工业常采用Pt~Rh合金作为催化剂 | |
| D. | 硫酸工业上SO2氧化成SO3,宜采用空气过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16:9 | B. | 23:9 | C. | 1:2 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期第IA族 | B. | 第四周期第IA族 | C. | 第三周期第ⅡA族 | D. | 第四周期第ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com