
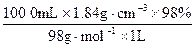 ="18.4" mol·L-1
="18.4" mol·L-1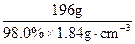 ="108.7" mL
="108.7" mL 2CuO
2CuO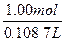 ="9.20" mol·L-1
="9.20" mol·L-1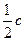 (浓H2SO4)=
(浓H2SO4)=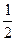 ×18.4 mol·L-1="9.20" mol·L-1。
×18.4 mol·L-1="9.20" mol·L-1。

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.浓硫酸的脱水性属于物理性质,相应的变化过程是物理变化 |
| B.蓝色石蕊试纸遇浓硫酸先变红后变黑 |
| C.浓硫酸可吸收三氧化硫 |
| D.胆矾(CuSO4·5H2O)投入到浓硫酸中,颜色由蓝变白 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
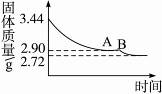
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.溶液中一定含有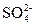 |
| B.溶液中一定含有Ag+ |
C.溶液中一定含有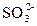 |
D.溶液中可能含有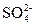 、 、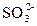 、Ag+中的某一种、两种或三种 、Ag+中的某一种、两种或三种 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
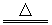 Fe2(SO4)3+SO2↑+4H2O?
Fe2(SO4)3+SO2↑+4H2O?查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.K2S和稀H2SO4 | B.K2SO3和盐酸 |
| C.K2S和盐酸 | D.K2SO3和稀H2SO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓H2SO4的脱水性属物理性质,相应的变化过程是物理变化 |
| B.蓝色石蕊试纸遇H2SO4先变红后变黑 |
| C.浓H2SO4可吸收SO3 |
| D.CuSO4·5H2O投入浓H2SO4中,固体颜色由蓝变白 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.Zn和稀H2SO4 | B.Na2SO3固体和浓H2SO4 |
| C.KI固体和浓H2SO4 | D.CaO和浓氨水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com