
【题目】下列关于分子组成表示为CxHy的烷、烯、炔烃说法不正确的是( )
A.当x≤4时,常温、常压下均为气体
B.y一定是偶数
C.分别燃烧1 mol,耗氧气为(x+![]() )mol
)mol
D.在密闭容器中完全燃烧,150℃时测得的压强一定比燃烧前压强大
【答案】D
【解析】
试题分析:A.对应烷烃、烯烃和炔烃中,碳原子数目≤4时,常温下都是气体,故A正确;B.烷、烯、炔烃分子中,烷烃的通式是CnH2n+2,单烯烃的通式是CnH2n(若是多个双键,则每多一个双键,H的个数减少2,因此氢数一定是偶数),炔烃的推断过程和烯烃类似,故B正确;C.烃燃烧时,1molC原子消耗1mol氧气、1mol氢原子消耗![]() mol氧气,所以1molCxHy完全燃烧消耗(x+
mol氧气,所以1molCxHy完全燃烧消耗(x+![]() )mol氧气,故C正确;D、120℃时水的状态为气体,1molCxHy完全燃烧消耗(x+
)mol氧气,故C正确;D、120℃时水的状态为气体,1molCxHy完全燃烧消耗(x+![]() )mol氧气,同时生成xmol二氧化碳、
)mol氧气,同时生成xmol二氧化碳、![]() mol水,当满足:1+(x+
mol水,当满足:1+(x+![]() )<x+
)<x+![]() ,即y>4时,反应后气体总压强增加,故D错误;故选D。
,即y>4时,反应后气体总压强增加,故D错误;故选D。


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】已知:Al、Fe、Cu 的合金与稀硝酸反应生成的气体只有 NO,实验过程如下:
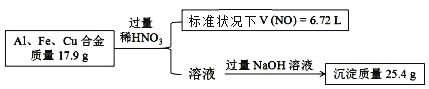
另取等量该合金,溶于足量 NaOH (aq),则可得气体的物质的量是
A. 0.22 mol B. 0.15 mol C. 0.3 mol D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液X中可能含有K+、Mg2+、Al3+、AlO、SiO、CO、SO、SO中的若干种离子。某同学对该溶液进行了如下实验:

下列判断正确的是( )
A. 气体甲一定是纯净物 B. 沉淀甲是硅酸和硅酸镁的混合物
C. K+、AlO和SiO一定存在于溶液X中 D. CO和SO一定不存在于溶液X中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和生铁(铁合金)都是生活中常见的材料,下列说法中正确的是( )
A.铁与盐酸反应,生铁不与盐酸反应B.铁和生铁都是金属单质
C.铁和生铁都能导电,都是电解质D.生铁的熔点比铁的熔点低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuBr是一种白色晶体,见光或潮湿时受热易分解,在空气中逐渐变为浅绿色。实验室制备CuBr的反应原理为:SO2+2CuSO4+2NaBr+ 2H2O=2CuBr↓+2H2SO4+Na2SO4,用下列装置进行实验,不能达到实验目的的是
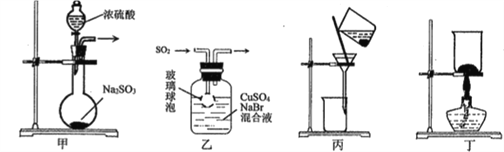
A. 用装置甲制取SO2 B. 用装置乙制取CuBr
C. 用装置丙避光将CuBr与母液分离 D. 用装置丁干燥CuBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为36.5%的浓盐酸(密度为1.16 g·cm-3)配制成1 mol·L-1的稀盐酸。现实验室仅需要这种盐酸220 mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为________mL的容量瓶。
(2)经计算需要________mL浓盐酸,在量取时宜选用下列量筒中的________。
A.5 mL B.10 mL C.25 mL D.50 mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入250 mL容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2 cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)____________。
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是________(填“偏高”、“偏低”或“无影响”)。若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度是________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的变化,能通过一步化学反应完成的是( )
A.Al→Al(OH)3B.Fe→FeCl2C.SiO2→Na2SiO3D.SiO2→H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1—溴丁烷的反应如下:
NaBr+H2SO4HBr+NaHSO4 ①
R—OH+HBr![]() R—Br+H2O ②
R—Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br—被浓硫酸氧化为Br2等。有关数据列表如下;
乙醇 | 溴乙烷 | 正丁醇 | 1—溴丁烷 | |
密度/g·cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
请回答下列问题:
(1)溴乙烷和1—溴丁烷的制备实验中,下列仪器最不可能用到的是________。(填字母)
a.圆底烧瓶 b.量筒 c.锥形瓶 d.长颈漏斗
(2)溴代烃的水溶性______(填“大于”、“等于”或“小于”)相应的醇,将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在______(填“上层”、“下层”或“不分层”)
(3)制备操作中,加入的浓硫酸必需进行稀释,其目的是____________。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是____________。(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于______________ ;
但在制备1—溴丁烷时却不能边反应边蒸出产物,其原因是_______________________。
(6)得到的溴乙烷中含有少量乙醇,为了制得纯净的溴乙烷,可用蒸馏水洗涤,分液后,再加入无水CaCl2后进行的实验操作是______(填字母)
a.分液 b.蒸馏 c.萃取 d.过滤
(7)为了检验溴乙烷中含有溴元素,通常采用的方法是取少量溴乙烷,然后______(按实验的操作顺序选填下列序号)①加热 ②加入AgNO3 ③加入稀HNO3 ④加入NaOH溶液.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com