
【题目】如右图为元素F、S、Cl在周期表中的位置,关于F、S、Cl的说法正确的是
A.非金属性:F > S > Cl B.原子半径:Cl > S > F
C.稳定性:HF > HCl > H2S D.酸性:HClO4 > H2SO4
He | ||
F | ||
S | Cl | |
科目:高中化学 来源: 题型:
【题目】某芳香酸类物质F常用做香精的调香剂。F的—种合成路线如下:
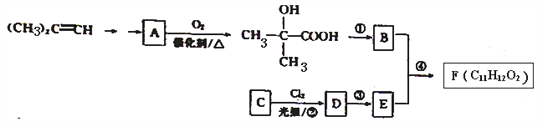
己知:A能发生银镜反应。回答下列问题:
(1)(CH3)2=CH2的化学名称为_________________,上述反应①、②、③、④中属于取代反应的有_______________。
(2)C的结构简式为_________,D中通过反应②引人的官能团名称为____________。
(3)①的反应条件是__________________。
(4)④的化学方程式为________________。
(5)B的同分异构体中,既能发生银镜反应又能发生水解反应的共有____种(不体异构),其中核磁共振氢谱显示为三组峰,且峰面积比为1:1:4的是________(填结构简式)。
(6)写出用(CH3)2C=CH2为原料(无机试剂任选)制备化合物A的合成路线:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验的基本操作是完成化学实验的关键,下列实验操作正确的是( )
①用50 mL量筒量取5.2 mL稀硫酸; ②用分液漏斗分离苯和四氯化碳的混合物;
③用托盘天平称量117.7 g氯化钠晶体; ④用量筒量取23.10 mL溴水;
⑤用蒸发皿高温灼烧石灰石; ⑥用250 mL容量瓶配制250 mL 0.2 mol·L-1的NaOH溶液;
A. ③⑥ B. ②③④⑤ C. ①②④ D. ②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数,下列说法错误的是
为阿伏加德罗常数,下列说法错误的是
A. 1 molH2所含氢气分子数为7![]()
B. 1 molAl与足量的稀盐酸溶液反应生成氢气1.5 mol
C. 在标准状况下,0.5![]() 个Cl2所占的体积约是11.2L
个Cl2所占的体积约是11.2L
D. 在标准状况下,22.4LH2O含有的分子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是( )
A. Fe3O4溶于足量稀HNO3:Fe3O4+8H+===Fe2++2Fe3++4H2O
B. 硅酸钠溶液与醋酸溶液混合:SiO![]() +2H+===H2SiO3↓
+2H+===H2SiO3↓
C. AlCl3溶液中滴入过量的氨水:Al3++4OH-===AlO![]() +2H2O
+2H2O
D. 向NaHCO3溶液中加入过量Ca(OH)2溶液:HCO![]() +Ca2++OH-===CaCO3↓+H2O
+Ca2++OH-===CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异戊酸薄荷酯P(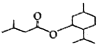 )是一种治疗心脏病的药物。一种制备异戊酸薄荷酯P的流程如下:
)是一种治疗心脏病的药物。一种制备异戊酸薄荷酯P的流程如下:

已知:
RCH=CH2 ![]() RCH2CHBr(R表示烃基)
RCH2CHBr(R表示烃基)
完成下列问题:
(1)A的化学名称为__________。
(2)试剂l的结构简式为__________。
(3)由E生成F的化学方程式为__________;该反应类型是__________。
(4)试剂2可以是__________试剂(填名称或化学式)
(5)由C和H生成P的化学方程式为__________。
(6)H的同分异构体中,能发生水解反应的链状化合物共有_________种(不考虑立体异构);其中核磁共振氢谱有两种峰、且峰值比为9:1的同分异构体的结构简式为__________。
(7)苯乙烯是一种重要的化工原料,参考制备异戊酸薄荷酯中的方法,设计以苯、乙烯为有机原料(无机试剂自选),制备苯乙烯的合成线路:
合成路线常用的表示方法为:![]()
________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种蔗糖燃料电池的装置如图所示,下列说法正确的是
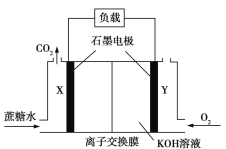
A.Y电极附近溶液pH减小
B.右室的K+移向左室
C.X电极的电极反应式为:C12H22O1136e+13H2O![]() 12CO2↑+48H+
12CO2↑+48H+
D.理论上电池工作时X电极生成的气体与Y电极消耗的气体物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+、I2,它们使用的药品和装置如图所示:
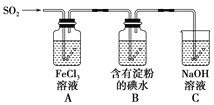
(1)A装置中发生反应的离子方程式为_________________________________________。
(2)B装置中发生反应的离子方程式为_________________________________________。
(3)下列实验方案适用于在实验室制取所需SO2的是________。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(4)装置C的作用是__________________________________________________。
(5)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有________(填序号)。
A.蒸发皿 B.石棉网 C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
(6)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是________,原因是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有标准状况下V L 气体AB3,它的摩尔质量为M g·mol-1。则:
(1)该气体所含原子总数为________________个(列出计算式即可,下同)。
(2)该气体的质量为_____________g。
(3)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为______________。
(4)该气体溶于水后形成1 L溶液,其溶液的物质的量浓度为_______________ mol·L-1。
(5)该气体溶于1L水中(不考虑反应),若所得溶液的密度为ρg·mL-1,则溶液的物质的量浓度为_____________________mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com