
| A. | ①②③④ | B. | ③④ | C. | ①③④ | D. | ①②③⑤ |
分析 ①氮气和氧气都是双原子分子,标况下11.2L混合气体的物质的量为0.5mol,含有1mol原子;
②相同条件下,等体积的任何气体含有的分子数一定相等;
③1L 2mol/L的氯化镁溶液中含氯离子为4NA;
④气体摩尔体积使用与气体;
⑤根据O2和O3均由氧原子构成来计算.
解答 解:①标准状况下,11.2L气体的物质的量为0.5mol,0.5mol氮气和氧气的混合气体中含有1mol原子,所含的原子数为NA,故正确;
②同温同压下,气体的摩尔体积相同,则体积相同的氢气和氩气的物质的量相同,所含的分子数相等,故正确;
③1L 2mol/L的氯化镁溶液中含氯离子为4NA,故正确;
④标准状况下,水不是气体,不能使用标况下的气体摩尔体积计算其物质的量,故错误;
⑤O2和O3均由氧原子构成,32gO2和O3含有的氧原子的物质的量n=$\frac{m}{M}$=$\frac{32g}{16g/mol}$=2mol,故含有原子数为2NA,故正确;
故选:D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
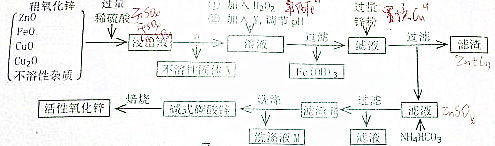
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
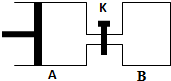 如图所示,容器A左侧是可平行移动的活塞.向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL.在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g)?Z(g)+2W(g),达到平衡时V(A)=1.2aL.试回答:
如图所示,容器A左侧是可平行移动的活塞.向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL.在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g)?Z(g)+2W(g),达到平衡时V(A)=1.2aL.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KAl (SO4)2=K++Al3++2 SO42- | B. | H2CO3=H++HCO3- | ||
| C. | Ca(HCO3)2=Ca2++2H++2CO32- | D. | Ba(OH)2=Ba2++OH2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
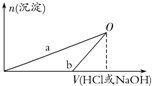 某同学研究铝及其化合物的性质时设计了如下两个实验方案.
某同学研究铝及其化合物的性质时设计了如下两个实验方案.| A. | b曲线表示的是向X溶液中加入NaOH溶液 | |
| B. | 在O点时两方案中所得溶液浓度相等 | |
| C. | 方案②中对应的O点HCl恰好反应完 | |
| D. | X溶液显酸性,Y溶液显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).合成路线流程图示例如下:
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).合成路线流程图示例如下: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | B极区电解液为LiCl溶液 | |
| B. | 电极每产生22.4L气体,电路中转移2mole- | |
| C. | 电解过程中Li+迁移入B电极区、OH-迁移入A电极区 | |
| D. | 电解池中总反应方程式为:2LiCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2LiOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com