
分析 (1)n(N2)=$\frac{0.168L}{22.4L/mol}$=0.0075mol,根据N原子守恒知,n(氨基酸)=2n(N2)=0.0075mol×2=0.015mol,其摩尔质量M=$\frac{m}{n}$=$\frac{1.995g}{0.015mol}$=133g/mol;
(2)26.6g该氨基酸物质的量=$\frac{26.6g}{133g/mol}$=0.2mol,n(NaOH)=1.6mol/L×0.25L=0.4mol,则氨基酸和氢氧化钠的物质的量之比=0.2mol:0.4mol=1:2,说明氨基酸中含有两个羧基,结合相对分子质量判断其结构简式.
解答 解:(1)n(N2)=$\frac{0.168L}{22.4L/mol}$=0.0075mol,根据N原子守恒知,n(氨基酸)=2n(N2)=0.0075mol×2=0.015mol,其摩尔质量M=$\frac{m}{n}$=$\frac{1.995g}{0.015mol}$=133g/mol,
答:其摩尔质量是133 g•mol-1;
(2 )26.6g该氨基酸物质的量=$\frac{26.6g}{133g/mol}$=0.2mol,n(NaOH)=1.6mol/L×0.25L=0.4mol,则氨基酸和氢氧化钠的物质的量之比=0.2mol:0.4mol=1:2,说明氨基酸中含有两个羧基,该氨基酸中还含有一个氨基,则还有C原子个数=$\frac{133-16-45×2}{12}$=2…3,所以还含有2个C原子、3个H原子,其结构简式为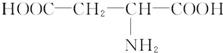 ,
,
答:其结构简式为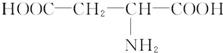 .
.
点评 本题考查根据化学方程式有关计算,侧重考查学生分析计算能力,明确各个物理量之间的关系是解本题关键,注意C原子个数计算方法,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | 步骤(1)产物中残留的苯酚可用FeCl3溶液检验 | |
| B. | 步骤(2)产物中残留的烯丙醇可用溴水检验 | |
| C. | 苯氧乙酸和菠萝酯均可与NaOH溶液发生反应 | |
| D. | 苯酚和菠萝酯均可与酸性KMnO4溶液发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
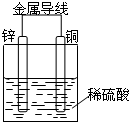
| A. | 锌为正极,发生氧化反应 | |
| B. | 铜为负极,铜片溶解 | |
| C. | 电子由铜片通过导线流向锌片 | |
| D. | 铜片上发生的电极反应:2 H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2、H2、NH3的物质的量不再改变 | |
| B. | c(N2):c(H2):c(NH3)=1:2:3 | |
| C. | N2与H2物质的量之和是NH3的2倍 | |
| D. | 单位时间里每增加1mol N2,同时增加3mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | W | R | X | Y | Z |
| 原子半径/nm | 0.037 | 0.154 | 0.066 | 0.070 | 0.077 |
| 主要化合价 | +1 | +1 | -2 | -3、+5 | +2、+4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 贝诺酯分子中有三种含氧官能团 | |
| B. | 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应 | |
| C. | 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| D. | 贝诺酯与足量NaOH溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
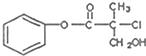
| A. | 该有机物可以在一定条件下与HBr发生反应 | |
| B. | 1mol该有机物最多能与4molH2发生加成反应 | |
| C. | 该有机物在一定条件下可以发生消去反应 | |
| D. | 1mol该有机物一足量的NaOH溶液反应,最多可以消耗3molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学反应原理在生活和工业中应用广泛.
化学反应原理在生活和工业中应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
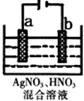
 在如图所示装置中,观察到电流表指针偏转,M棒(左)变粗,N棒(右)变细,由此判断下表中所列M、N、P物质,其中可以成立的是( )
在如图所示装置中,观察到电流表指针偏转,M棒(左)变粗,N棒(右)变细,由此判断下表中所列M、N、P物质,其中可以成立的是( )| M | N | P | |
| A | 锌 | 铜 | 稀硫酸溶液 |
| B | 铜 | 铁 | 稀盐酸 |
| C | 银 | 锌 | 硝酸银溶液 |
| D | 铜 | 铁 | 硝酸铁溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com