
| A£® | ·“Ó¦¢ŁÖŠµēÄÜ×Ŗ»ÆĪŖ»ÆѧÄÜ | |
| B£® | ·“Ó¦¢ŚĪŖ·ÅČČ·“Ó¦ | |
| C£® | ·“Ó¦¢ŪŹ¹ÓĆ“ß»Æ¼Į£¬”÷H3¼õŠ” | |
| D£® | ·“Ó¦¢ŚÖŠ£¬·“Ó¦ĪļµÄ¼üÄÜ“óÓŚÉś³ÉĪļµÄ¼üÄÜ |
·ÖĪö A£®ĄūÓĆĢ«Ńō¹āÄÜÖĘĒāĘų£¬ŹĒ¹āÄÜ×Ŗ»ÆĪŖ»ÆѧÄÜ£»
B£®”÷H2£¾0£¬·“Ó¦ĪŖĪüČČ·“Ó¦£»
C£®“߻ƼĮ²»ÄÜøı䷓ӦČČµÄ“óŠ”£»
D£®ĪŖĪüČČ·“Ó¦£¬¶ĻĮŃ»Æѧ¼üĪüŹÕµÄÄÜĮæ“óÓŚŠĪ³É»Æѧ¼ü·Å³öµÄÄÜĮ森
½ā“š ½ā£ŗA£®Ģ«Ńō¹ā“߻ƷֽāĖ®ÖĘĒāĘų£¬ŹĒ¹āÄÜ×Ŗ»ÆĪŖ»ÆѧÄÜ£¬¹ŹA“ķĪó£»
B£®·“Ó¦µÄ”÷H2=131.3kJ•mol-1£¾0£¬¹ŹøĆ·“Ó¦ĪŖĪüČČ·“Ó¦£¬¹ŹB“ķĪó£»
C£®“߻ƼĮ²»ÄÜøı䷓ӦČČµÄ“óŠ”£¬Ö»ÄÜøıä»Æѧ·“Ó¦ĖŁĀŹ£¬¹ŹC“ķĪó£»
D£®ĪŖĪüČČ·“Ó¦£¬¶ĻĮŃ»Æѧ¼üĪüŹÕµÄÄÜĮæ“óÓŚŠĪ³É»Æѧ¼ü·Å³öµÄÄÜĮ棬Ōņ·“Ó¦ĪļµÄ¼üÄÜ“óÓŚÉś³ÉĪļµÄ¼üÄÜ£¬¹ŹDÕżČ·£®
¹ŹŃ”D£®
µćĘĄ ±¾Ģāæ¼²éĮĖ»Æѧ·“Ó¦ÓėÄÜĮæ±ä»Æ£¬ĪŖøßĘµæ¼µć£¬ĄūÓĆøĒĖ¹¶ØĀɽųŠŠĻą¹Ų¼ĘĖć£¬×¢Ņā“߻ƼĮ²»ÄÜøıäģŹ±ä£¬øĒĖ¹¶ØĀɼĘĖ揱ģŹ±äµÄ¼Ó¼õŹ±ÕżøŗŗÅ£¬ĪŖŅדķµć£¬ĢāÄæÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | »ģŗĻĘųĢåµÄŃÕÉ«²»ŌŁøıä | B£® | »ģŗĻĘųĢåµÄĆÜ¶Č²»ŌŁøıä | ||
| C£® | »ģŗĻĘųĢåµÄŃ¹Ēæ²»ŌŁøıä | D£® | »ģŗĻĘųĢåµÄĘ½¾ł·Ö×ÓÖŹĮæ²»ŌŁøıä |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ¼×“¼ŹĒŅ»ÖÖæÉŌŁÉśÄÜŌ“£¬¾ßÓŠ¹ć·ŗµÄæŖ·¢ŗĶÓ¦ÓĆĒ°¾°£®
¼×“¼ŹĒŅ»ÖÖæÉŌŁÉśÄÜŌ“£¬¾ßÓŠ¹ć·ŗµÄæŖ·¢ŗĶÓ¦ÓĆĒ°¾°£®| ĪĀ¶Č | 250”ę | 300”ę | 350”ę |
| K | 2.041 | 0.270 | 0.012 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
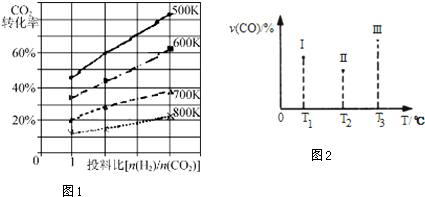
| A£® | Ķ¼¢ńŃŠ¾æµÄŹĒt0Ź±æĢŌö“óO2µÄÅØ¶Č¶Ō·“Ó¦ĖŁĀŹµÄÓ°Ļģ | |
| B£® | Ķ¼¢óŃŠ¾æµÄŹĒĪĀ¶Č¶Ō»ÆŃ§Ę½ŗāµÄÓ°Ļģ£¬ĒŅŅŅµÄĪĀ¶Č½ĻµĶ | |
| C£® | Ķ¼¢óŃŠ¾æµÄŹĒ“߻ƼĮ¶ŌĘ½ŗāµÄÓ°Ļģ£¬ĒŅ¼×µÄ“߻Ɗ§ĀŹ±ČŅŅøß | |
| D£® | Ķ¼¢ņŃŠ¾æµÄŹĒt0Ź±æĢ¼ÓČė“߻ƼĮŗó¶Ō·“Ó¦ĖŁĀŹµÄÓ°Ļģ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŠčŅŖ¼ÓČČ²ÅÄÜ·¢ÉśµÄ·“Ó¦Ņ»¶ØŹĒĪüČČ·“Ó¦ | |
| B£® | ”÷H£¾0±ķŹ¾²śĪļµÄ×ÜÄÜĮæµĶÓŚ·“Ó¦ĪļµÄ×ÜÄÜĮæ | |
| C£® | ”÷H µÄµ„Ī»kJ•mol-1£¬ČČĮæQµÄµ„Ī»ĪŖkJ | |
| D£® | »Æѧ¼ü¶ĻĮŃ¹ż³ĢÖŠŹĶ·ÅÄÜĮæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | c£ØB2-£©+c£ØHB-£©=0.1 mol/L | B£® | c£ØB2-£©+c£ØHB-£©+c£ØH2B£©=0.1 mol/L | ||
| C£® | c£ØOH-£©=c£ØH+£©+c£ØHB-£©+2c£ØH2B£© | D£® | c£ØNa+£©+c£ØOH-£©=c£ØH+£©+c£ØHB-£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
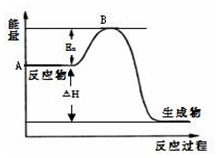 2SO2£Øg£©+O2£Øg£©?2SO3£Øg£©”÷H=a kJ•mol-1£¬·“Ó¦¹ż³ĢµÄÄÜĮæ±ä»ÆČēĶ¼ĖłŹ¾£®ŅŃÖŖ1mol SO2£Øg£©ĶźČ«×Ŗ»ÆĪŖ1mol SO3£Øg£©·ÅČČ99kJ£®Ēė»Ų“š£ŗ
2SO2£Øg£©+O2£Øg£©?2SO3£Øg£©”÷H=a kJ•mol-1£¬·“Ó¦¹ż³ĢµÄÄÜĮæ±ä»ÆČēĶ¼ĖłŹ¾£®ŅŃÖŖ1mol SO2£Øg£©ĶźČ«×Ŗ»ÆĪŖ1mol SO3£Øg£©·ÅČČ99kJ£®Ēė»Ų“š£ŗ²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com