
氮化铝广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C  2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
A.Al2O3是氧化剂,C是还原剂 B.每生成1molCO需转移2mol电子
C.AlN中氮元素的化合价为+3 D.AlN的摩尔质量为41
科目:高中化学 来源: 题型:
下列离子方程式中正确的是( )
A.澄清石灰水与稀盐酸反应Ca(OH)2+2H+===Ca2++ 2H2O
2H2O
B.氢氧化钡与硫酸反应OH-+H+===H2O
C.铜片插入硝酸银溶液中Cu+Ag+===Cu2++Ag
D.氯化镁溶液与氢氧化钠溶液反应Mg2++2OH-===Mg(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列方程式:⑴2Fe2++Cl2=2Fe3++2Cl- ;⑵HClO+HCl=Cl2+H2O ;⑶2Fe3++Cu=2Fe2++Cu2+;⑷Fe+Cu2+=Fe2++Cu,判断下列 各组物质氧化性强弱顺序正确的是
各组物质氧化性强弱顺序正确的是
A.Fe3+> HClO>Cl2>Fe2+>Cu2+ B.HClO>Cl2>Fe3+>Cu2+>Fe2+
HClO>Cl2>Fe2+>Cu2+ B.HClO>Cl2>Fe3+>Cu2+>Fe2+
C.Cl2>HClO>Fe3+>Cu2+>Fe2+ 
 D.HClO>Fe3+>Cl2
D.HClO>Fe3+>Cl2 >Cu2+>Fe2+
>Cu2+>Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
在氧化还原反应中,电子转移的表示方法通常用单线桥法和双线桥法。试分析这两种表示方法的特征,并填空。
(1)单线桥法
KClO3+6HCxe-l===KCl+3Cl2↑+3H2O反应中电子转移数目x=________,氧化剂是________,还原剂是________。
(2)双线桥法
2KClO3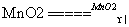 2KC得xe-l+3O2失xe-,反应中,KClO3中的氯元素共得________电子,化合价________,被________,氧元素共失去______电子,化合价________被________;氧化剂是________,还原剂是________。
2KC得xe-l+3O2失xe-,反应中,KClO3中的氯元素共得________电子,化合价________,被________,氧元素共失去______电子,化合价________被________;氧化剂是________,还原剂是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下:
①滴加适量H2O2,紫红色褪去,并有气泡产生;
②再加入适量的PbO2固体,固体溶解,溶液又变为紫红色;
③最后通入足量的SO2气体。
请回答下列问题:
(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为________________________;
(2)实验③中的现象为_________________________________________________;
(3)实验①、②中反应的离子方程式分别是__________________、____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列应用不涉及氧化还原反应的是( )
A.Na2O2用作呼吸面具的供氧剂
B.工业上电解熔融状态的Al2O3制备Al
C.工业上利用合成氨实现人工固氮
D.实验室用NH4Cl和Ca(OH)2制备NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
年来,许多专家对石灰氮重新进行了深入研究,这也使得石灰氮这一古老的肥料又焕发了新的活力。石灰氮是由Ca、N、C等三种元素组成的盐,其含钙、氮的质量分数分别为50 %、35%。石灰氮完全水解后的产物是固体A和气体B,其中B是制取氮肥的主要原料。固体A在高温下分解生成D和气体C。B的催化氧化产物为E和F,F继续氧化后的产物G遇到E生成一种工业强酸。将G和F的混合物溶解在接近零度的水中,即生成亚硝酸的水溶液,该反应可表示如下G+F+H2O=2HNO2(已配平)。请回答下列问题:
%、35%。石灰氮完全水解后的产物是固体A和气体B,其中B是制取氮肥的主要原料。固体A在高温下分解生成D和气体C。B的催化氧化产物为E和F,F继续氧化后的产物G遇到E生成一种工业强酸。将G和F的混合物溶解在接近零度的水中,即生成亚硝酸的水溶液,该反应可表示如下G+F+H2O=2HNO2(已配平)。请回答下列问题:
(1)石灰氮的化学式为 。
(2)足量B和C与饱和氯 化钠溶液的反应是化工生产中生产某种重要化工产品的重要反应,试写出其化学方程式
化钠溶液的反应是化工生产中生产某种重要化工产品的重要反应,试写出其化学方程式  。
。
(3)亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸,很不稳定,通常在室温下立即分解。在酸性条件下,当NaNO2与KI按物质的量1:1恰好完全反应,且I— 被氧化为I2时,含氮产物为 (填化学式)。要得到稳定HNO2溶液,可以往冷冻的浓NaNO2溶液中加入或通入某种物质,下列物质中不适合使用是 (填序号)。
a、磷酸 b、二氧化碳 c、稀硫酸 d、二氧化硫 e、次氯酸
(4)工业废水中的NO2— 可用铝粉除去。已知此反应体系中包含Al、NaAlO2、NaNO2、NaOH、NH3、H2O六种物质。写出上述反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
乙醇、乙酸都是有机化工重要的基础原料。
(1).空气中,乙醇蒸气能使红热铜丝保持红热,该反应的化学方程式为 。
(2).浓硫酸催化下,乙酸和乙醇生成乙酸乙酯
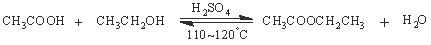
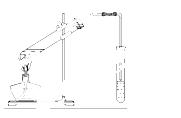
某化学兴趣小组的同学用以下装置进行该酯化反应的探究实验:
①要向大试管中加2mL浓硫酸、 3mL乙醇、2mL乙酸,其具体操作是 。
3mL乙醇、2mL乙酸,其具体操作是 。
②小试管中装的是浓Na2CO3溶液,导气管不插入液面下是为了防止 。
③相关物质的部分性质:
| 乙醇 | 乙酸 | 乙酸乙酯 | |
| 沸点 | 78.0℃ | 117.9℃ | 77.5℃ |
| 水溶性 | 易溶 | 易溶 | 难溶 |
根据上表数据有同学提出可用水替代小试管中的Na2CO3溶液,你认为可行吗?说明理由: 。④分离小试管中的乙酸乙酯应使用的仪器名称是 ;
⑤分离时,乙酸 乙酯应该从仪器 (填“下口放” 或“上口倒出”)。
乙酯应该从仪器 (填“下口放” 或“上口倒出”)。
⑥兴趣小组多次试验后,测出乙醇与乙酸用量和最后得到的乙酸乙酯生成量如下表:
| 实验序号 | 乙醇(mL) | 乙酸(mL) | 乙酸乙酯(mL) |
| a | 2 | 2 | 1.33 |
| b | 3 | 2 | 1.57 |
| c | 4 | 2 | X |
| d | 5 | 2 | 1.76 |
| e | 2 | 3 | 1.55 |
表中数据X的范围是 ;实验a与实验e探究的目的是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com