
分析 I.(1)取0.1mol/L的HA溶液与0.1mol/L的NaOH溶液等体积混合(忽略混合后溶液体积的变化),二者的物质的量相同,恰好完全反应生成NaA,测得混合溶液的pH=8,说明NaA水解呈碱性;
(2)含有弱根离子的盐能促进水电离,酸或碱能抑制水电离;
(3)根据电荷守恒和质子守恒及pH分析;
(4)根据题意知,HA的酸性比碳酸强,NH4A溶液为中性,说明铵根离子和该酸根离子水解程度相同,由此得知铵根离子水解程度小于碳酸根离子,所以(NH4)2CO3中溶液呈碱性;
II.pH相等的三种酸,氢离子浓度相等,硫酸浓度是盐酸的$\frac{1}{2}$,醋酸的浓度大于氢离子的浓度;
III.根据Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-),结合已知离子浓度计算.
解答 解:I.(1)等物质的量的一元酸和一元碱恰好反应生成盐和水,生成的盐溶液呈碱性说明该酸是弱酸,生成的盐能水解导致溶液中氢氧根离子浓度大于氢离子浓度,溶液的pH值大于7,水解方程式为:A-+H2O?HA+OH-,
故答案为:A-+H2O?HA+OH-;
(2)该盐含有弱根离子能促进水电离,氢氧化钠是强碱能抑制水电离,所以混合溶液中由水电离出的c(H+)大于0.1mol•L-1NaOH溶液中由水电离出的c(H+),
故答案为:大于;
(3)由电荷守恒可知,c(Na+)-c(A-)=c(OH-)-c(H+)=10-6-10-8=9.9×10-7mol/L,
故答案为:9.9×10-7;
(4)将HA溶液加到Na2CO3溶液中有气体放出,说明HA的酸性比碳酸的强,NH4A溶液为中性,说明相同条件下,氨水和HA的电离程度相同,所以(NH4)2CO3中铵根离子的水解程度小于碳酸根离子的水解程度,溶液显碱性,即溶液的pH大于7;
故答案为:大于;
II.盐酸是一元强酸完全电离,硫酸是二元强酸完全电离,醋酸是弱酸部分电离,[H+]相同时,醋酸浓度最大,硫酸的浓度最小,所以物质的量浓度由大到小的顺序是c3>c1>c2,
故答案为:c3>c1>c2;
III.(3)已知某地海水中的镁离子的浓度为1.8×10-3 mol•L-1,则c2(OH-)=$\frac{{K}_{sp}[Mg(OH)_{2}]}{c(M{g}^{2+})}$,
则c(OH-)=$\sqrt{\frac{1.8×1{0}^{-11}}{1.8×1{0}^{-3}}}$=1.0×10-4 mol•L-1,
则c(H+)=1.0×10-10mol•L-1,所以pH=10;
故答案为:10.
点评 本题考查了弱电解质的电离、酸碱混合溶液定性判断、溶度积常数的有关计算等知识点,根据弱电解质电离特点及酸碱中和反应来分析解答,明确物质的性质是解本题关键,再结合基本概念、pH的计算、物料守恒等知识点分析,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯气的性质活泼,它与氢气混合后立即发生爆炸 | |
| B. | 检验HCl气体中是否混有Cl2方法是将气体通入硝酸银溶液 | |
| C. | 浓HCl在与MnO2共热制取Cl2的实验中只起到还原剂的作用 | |
| D. | 实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钠溶液吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将白炽灯换成节能灯 | B. | 少开汽车,多骑自行车或坐公交车 | ||
| C. | 用风力发电代替火力发电 | D. | 把高耗能产业转移到欠发达地区 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2 与CO2均为直线形非极性分子 | |
| B. | 熔点:SiCl4<MgCl2<SiO2 | |
| C. | 水加热到很高的温度都难以分解,是因为水中含有氢键 | |
| D. | 断裂化学键的过程不一定发生化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | 铁与稀盐酸反应: 2Fe+6H+═2Fe3++3H2↑ | 正确 |
| B | 大理石溶于醋酸的反应: CaCO3+2H+═Ca2++CO2↑+H2O | 错误,醋酸应写为分子形式CH3COOH,CaCO3应写成离子形式 |
| C | FeCl3溶液“腐蚀”铜箔: Fe3++Cu═Fe2++Cu2+ | 正确 |
| D | NH4HCO3溶液与过量NaOH浓溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | 错误,HCO3-也可以与OH-反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
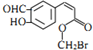
| A. | 该有机物含有六种官能团 | |
| B. | 该有机物属于芳香烃 | |
| C. | 该有机物可发生取代、加成、加聚、氧化、还原、削去反应 | |
| D. | 1 mol该有机物在适当条件下,最多可与5 molH2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙酸均可与钠反应放出氢气 | |
| B. | 乙烯和苯均能使溴水褪色,且原理相同 | |
| C. | 等物质的量的正丁烷和异丁烷,含有非极性键的数目相同 | |
| D. | 甲烷在光照条件下与Cl2发生取代反应,共得到5种产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉和明矾常用于水处理,这两者净水原理相同 | |
| B. | “地沟油”经过加工处理可用来制肥皂,可实现厨余废物合理利用 | |
| C. | 碳酸钠在医疗上是治疗胃酸过多的一种药剂 | |
| D. | 高炉炼铁的常用FeS2作为炼铁的原料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com