
25℃时,下列溶液中微粒的 物质的量浓度关系正确的是
物质的量浓度关系正确的是
A.0.l mol·L﹣lNaHC2O4溶液(pH=5.5):c(Na+)>c(HC2O4﹣)>c(H2C2O4)>c(C2O42﹣)
B.0.l mol·L﹣1NaHS溶液:c(OH﹣) + c(S2﹣)=c(H+) + c(H2S)
C.0.l mol·L﹣1CH3COOH 溶液和0.l mol·L﹣1CH3COONa 溶液等体积混合:
c(Na+)>c(CH3COOH)>c(CH3COO﹣)>c(H+)>c(OH﹣)
D.0.l mol·L﹣lNH4HSO4 溶液中滴加0.l mol·L﹣1NaOH溶液至中性:
C(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)=c(H+)
科目:高中化学 来源:2017届河北省高三上调研四化学试卷(解析版) 题型:选择题
某小组用下图装置进行实验,下列说法正确的是
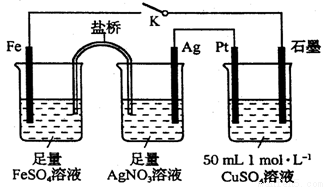
A.盐桥中的电解质可以用KCl
B.闭合K,外电路电流方向为Fe电极→石墨电极
C.闭合K,石墨电极上只生成铜
D.导线中流过0.15mol电子时,加入5.55gCu2(OH)2CO3,CuSO4溶液可恢复原组成
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上月考四化学试卷(解析版) 题型:填空题
过氧化氢其水溶液适用于医用伤口消毒及环境消毒和食品消毒。
Ⅰ.过氧化氢性质实验
(1)酸性条件下H2O2可将水中的Fe2+转化成Fe3+,由此说明H2O2具有___________性。请写出该反应离子方程式: 。
(2)已知H2O2是一种二元弱酸,其中Ka1=1.0×10-12、Ka2=1.05×10-25;则H2O2的电离方程式为 ,常温下1mol·L-1的 H2O2溶液的pH为 。
H2O2溶液的pH为 。
Ⅱ.过氧化氢含量的实验测定
兴趣小组同学用0.1000 mol·L-1酸性高锰酸钾标准溶液滴定试样中过氧化氢的含量,反应原理为:2MnO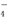 +5H2O2+6H+=2Mn2++8H2O+5O2↑。
+5H2O2+6H+=2Mn2++8H2O+5O2↑。
(3)滴定到达终点的现象是____________________。
(4)用移液管吸取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗的KMnO4标准溶液体积如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
计算试样中过氧化氢的浓度为__________mol·L-1。
(5)若滴定前尖嘴中有气泡,滴定后消失,则测定结果________(“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上月考四化学卷(解析版) 题型:选择题
如图所示,下列说法正确的是( )
A.甲池通入O2的电极反应为O2 + 4e-+ 4H+=2H2O
B.乙池 Ag电极增重6.4g,溶液中将转移0.2mol电子
C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度
D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三12月月考化学试卷(解析版) 题型:实验题
实验室用下图所示装置制备AlCl3溶液,并用AlC l
l 3溶液溶解一定量的CaCO3形成溶液,再用氨水沉淀,然后煅烧沉淀制备新型的超导材料和发光材料七铝十二钙(12CaO·7Al2O3)。已知AlCl3易水解,易升华。
3溶液溶解一定量的CaCO3形成溶液,再用氨水沉淀,然后煅烧沉淀制备新型的超导材料和发光材料七铝十二钙(12CaO·7Al2O3)。已知AlCl3易水解,易升华。
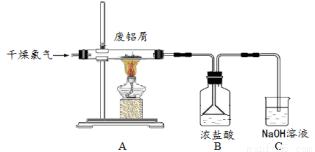
(1)实验室用氯酸钾和浓盐酸制备氯气,其离子方程式为  ;C装置的作用 。
;C装置的作用 。
(2)氯气与废铝屑反应生成的AlCl3蒸气溶解在B中浓盐酸,为了防止AlCl3蒸气凝华堵塞 导管,实验中可采取的措施是 (写出一点)。
导管,实验中可采取的措施是 (写出一点)。
(3)AlCl3溶液溶解CaCO3时,AlCl3 溶液和碳酸钙粉末的混合方式为 。
溶液和碳酸钙粉末的混合方式为 。
(4)实验要控制碳酸钙和AlCl3的量,要求n(CaCO3)∶n(AlCl3)> 。
(5)用白云石(主要成分为CaCO3、MgCO3)制备纯净碳酸钙的实验方案为:将一定量的白云石煅烧, 。(实验中需用到的试剂有:硝酸铵溶液,氨气,二氧化碳;需要用到的仪器:pH计。已知:镁的化合物不溶于硝酸铵溶液;pH值为11~12时得到较纯净碳酸钙沉淀)。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三12月月考化学试卷(解析版) 题型:选择题
图1为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,图2为电解AlCl3溶液的装置,电极材料均为石墨。用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀。下列说法正确的是
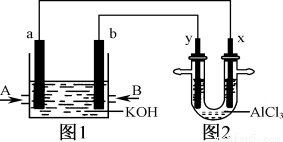
A.图1中电解质溶液的pH增大
B.图2中电解AlCl3溶液的总反应为2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.A处通入的气体为CH4,电极反应式为CH4+10OH--8e-= CO32-+7H2O
D.电解池中Cl-向x极移动
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三12月月考化学试卷(解析版) 题型:选择题
下列有关化学用语的表示正确的是
A.HBrO的电子式: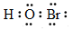
B.乙炔的分子结构模型示意图:
C.中子数为18的氯原子结构示意图: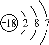
D.碳酸氢钠的电离方程式:NaHCO3 Na++H++CO
Na++H++CO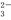
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上期中化学试卷(解析版) 题型:选择题
设NA代表阿伏加德罗常数的数值。下列有关叙述正确的是
①标准状况下,2.24LH2O含有的分子数等于0.1NA
②23gNa在氧气中完全氧化失电子数一定为NA
③1mol硫酸钾中阴离子所带电荷数为NA
④常温常压下,32gO2或O3中所含电子数为16 NA
⑤由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2 NA
A.①②⑤ B.②③⑤ C.③④⑤ D.②④⑤
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上大考二化学卷(解析版) 题型:填空题
某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A===H++HA-,HA- H++A2-回答下列问题:
H++A2-回答下列问题:
(1)Na2A溶液显________(填“酸性”“中性”或“碱性”),用离子方程式表示其原因________________。
(2)在0.1 mol·L-1的Na2A溶液中,下列微粒浓度关系式正确的是____________。
A.c(A2-)+c(HA-)+c(H2A)=0.1 mol·L-1
B.c(OH-)=c(H+)+c(HA-)+2c(H2A)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)
D.c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
(3)常温下,已知0.1 mol·L-1NaHA溶液的pH=2,则0.1 mol·L-1H2A溶液中c(H+)可能___________(填“>”、“<”或“=”)0.11 mol·L-1;理由是_______________________。
(4)比较①0.1 mol·L-1 Na2A溶液 ②0.1 mol·L-1 Na2SO4溶液,两种溶液中阴离子总浓度的大小①________②(填“>”、“<”或“=”)。
(5)O3可由臭氧发生器(原理如图)电解稀硫酸制得。
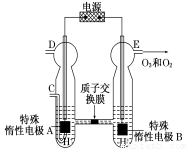
①图中阴极为______________(填“A”或“B”),其电极反应式 为_______________________。
为_______________________。
②若C处通入O2,则A极的电极反应式为______________。
③若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况),则E处收集的气体中O3所占的体积分数为______________(忽略O3的分解)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com