
【题目】I.金属矿物资源以及海水资源的利用有着非常重要的意义。
Ⅰ(1)金属铁常用的冶炼方法是____________(填序号);
A.热分解法 B.热还原法 C.电解法 D.湿法冶金
(2)利用冶炼得到的铁屑和海带中提取的碘可以用于生产KI,其工艺流程如图所示:
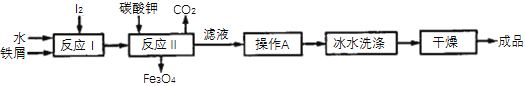
①操作A包括________________、_____________、过滤。
②用冰水洗涤的目的是:a除去附着在KI表面的可溶性杂质:b._________________。
③反应Ⅰ生成了铁与碘的化合物X,若X中铁元素与碘元素的质量比为21∶127,则X的化学式为__________________;反应Ⅱ中1molX完全反应生成89.6L(标准状况)CO2,写出反应Ⅱ的化学方程式:______________________________________________。
Ⅱ.工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:

(3)气体A中的大气污染物可选用下列试剂中的____________吸收。
a.浓HSO4 b.稀HNO3 c.NaOH溶液 d.氨水
(4)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在_____(填离子符号),检验溶液中还存在Fe2+的方案是:____________________________。
(5)在一定量的精铜中加入足量的稀HNO3溶液,该反应的离子方程式为________________。
(6)由泡铜冶炼粗铜的化学反应方程式为______________________________________。
【答案】B 加热浓缩 冷却结晶 同时减少KI的溶解损失 Fe3I8 Fe3I8+4K2CO3=Fe3O4+8KI+4CO2↑ c d Fe3+ 取少量溶液,滴加KMnO4溶液,KMnO4褪色 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 3Cu2O+2Al![]() Al2O3+6Cu
Al2O3+6Cu
【解析】
Ⅰ(1)金属的冶炼一般有电解法、热还原法、热分解法、物理分离法。电解法:冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的三氧化二铝)制得;热还原法:冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,常用还原剂有(C、CO、H2等);热分解法:Hg、Ag用加热分解氧化物的方法制得,物理分离法:Pt、Au用物理分离的方法制得;
(2)①得到碘化钾,需要经过加热浓缩、冷却结晶、过滤,再降温、干燥得到碘化钾固体;
②冰水洗涤的目的是:洗涤除去表面可溶性杂质,同时减少KI的溶解损失;
③铁元素与碘元素的质量比为21:127,铁、碘原子个数比为3:8,反应Ⅰ生成了Fe3I8,反应中Ⅱ1mol X完全反应生成89.6L(标准状况)CO2,据此根据得失电子守恒可知,书写反应Ⅱ的化学反应方程式;
Ⅱ由流程可知,黄铜矿加入石英砂通入空气焙烧,可生成Cu2S、CuO,继续加入石英砂通入空气焙烧,生成Cu2O、Cu,生成气体A为二氧化硫,熔渣B为FeO等,Cu2O、Cu与铝在高温下发生铝热反应得到粗铜,电解可得到精铜,根据分析解答。
Ⅰ(1)A.冶炼不活泼的金属,用热分解法,如Hg、Ag用加热分解氧化物的方法制得,故A错误;
B.热还原法冶炼较不活泼的金属Fe、Cu,常用还原剂有(C、CO、H2等),故B正确;
C.电解法冶炼活泼金属Na、Al,一般用电解熔融的氯化物(Al是电解熔融的三氧化二铝)制得,故C错误;
D.湿法冶金用较活泼的金属从溶液中置换出活泼性相对弱的金属,如我国古代利用铁和硫酸铜溶液反应炼铜,反应为Fe+CuSO4=Cu+FeSO4,属于湿法冶金,故D错误;
故答案为:B;
(2)①反应Ⅱ的滤液需要经过加热浓缩、冷却结晶、过滤,初步得到碘化钾;
②冰水晶体溶解度小,由于碘化钾混有可溶性杂质,需要经过洗涤才能得到较纯净的产品,故用冰水洗涤,洗涤除去表面可溶性杂质,同时减少KI的溶解损失;
③铁元素与碘元素的质量比为21:127,铁、碘原子个数比为![]() :
:![]() =3:8,反应Ⅰ生成了Fe3I8,反应中Ⅱ1molX完全反应生成89.6L(标准状况)CO2,生成二氧化碳气体的物质的量为
=3:8,反应Ⅰ生成了Fe3I8,反应中Ⅱ1molX完全反应生成89.6L(标准状况)CO2,生成二氧化碳气体的物质的量为![]() =4mol,所以反应Ⅱ是Fe3I8和碳酸钾反应生成四氧化三铁、二氧化碳与KI,反应Ⅱ的反应方程式是:Fe3I8+4K2CO3=Fe3O4+8KI+4CO2↑;
=4mol,所以反应Ⅱ是Fe3I8和碳酸钾反应生成四氧化三铁、二氧化碳与KI,反应Ⅱ的反应方程式是:Fe3I8+4K2CO3=Fe3O4+8KI+4CO2↑;
Ⅱ(3) 由流程图转化可知,气体A中的大气污染物主要是二氧化硫,选择试剂吸收二氧化硫,不能产生新的污染气体,
a.浓H2SO4不能吸收二氧化硫,故a错误;
b.稀HNO3可以吸收二氧化硫,但生成NO污染大气,故b错误;
c.NaOH溶液与二氧化硫反应生成亚硫酸钠,故c正确;
d.氨水与二氧化硫反应生成亚硫酸铵,故d正确;
故选cd;
(4)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明含有Fe3+;Fe2+具有还原性,可以利用KMnO4溶液检验,取少量溶液,滴加KMnO4溶液,KMnO4溶液紫色褪去;
(5)铜和稀硝酸反应生成硝酸铜、一氧化氮和水,反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(6)由流程图转化可知,Cu2O与Al反应置换反应生成Al2O3与Cu,反应方程式为3Cu2O+2Al![]() Al2O3span>+6Cu。
Al2O3span>+6Cu。


科目:高中化学 来源: 题型:
【题目】一定条件下铁可以和 CO2 发生反应:Fe(s)+CO2(g)FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的 CO2 气体,反应过程中 CO2 气体和 CO 气体的浓度与时间的关系如图所示:

(1)t1 时,正、逆反应速率的大小关系为 v 正_____v 逆(填“>”“<”或“=”)。
(2)4 min 内,CO 的平均反应速率 v(CO)=_____。
(3)下列条件的改变能减慢其反应速率的是_____(填序号,下同)。
①降低温度
②减少铁粉的质量
③保持压强不变,充入 He 使容器的体积增大
④保持容积不变,充入 He 使体系压强增大
(4)下列描述能说明上述反应已达平衡状态的是_____。
①v(CO2)=v(CO)
②单位时间内生成 n mol CO2 的同时生成 n mol CO
③容器中气体压强不随时间变化而变化
④容器中气体的平均相对分子质量不随时间变化而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图装置完成表中的四个实验,不能达到实验目的的是
实验装置 | 实验目的 | 试剂X | 试剂Y | |
| A. | 检验C2H5Br消去反应后的气体产物 | 水 | 酸性KMnO4溶液 |
B. | 检验C2H5OH消去反应后的气体产物 | NaOH溶液 | Br2的CCl4溶液 | |
C. | 比较醋酸、碳酸、苯酚酸性强弱 | NaOH溶液 | 苯酚钠溶液 | |
D. | 检验制取乙炔时的气体产物 | CuSO4溶液 | 酸性KMnO4溶液 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是基本有机化工原料,由乙炔制各聚乙烯醇和顺式聚异戊二烯的合成路线(部分反应条件略去)如图所示:
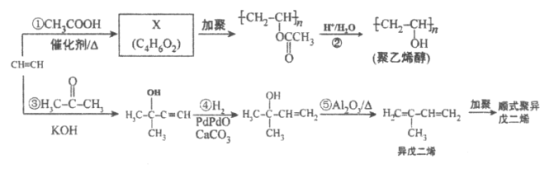
回答下列问题:
(1)按系统命名法命名异戊二烯:__________________________。
(2)写出X加聚的化学反应方程式_____________。
(3)反应①~③中,与反应④的反应类型不同的是_____________(填反应序号)反应⑤属于_____________反应。
(4)与乙炔具有相同官能团的异戊二烯的同分异构体共有_____________种。
(5)X的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是_____(选填字母)。
a. 质谱仪 b. 红外光谱仪 c. 元素分析仪 d. 核磁共振仪
(6)顺式聚异戊二烯的结构式是(选填字母)_____________。
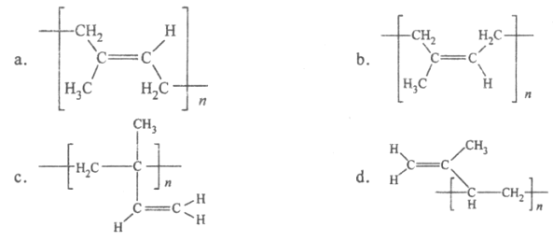
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫的催化氧化原理为2SO2(g)+O2(g)![]() 2SO3(g)。在一定压强下,反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示。下列说法不正确的是
2SO3(g)。在一定压强下,反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示。下列说法不正确的是
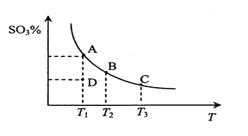
A. 反应2SO2(g)+O2(g)![]() 2SO3(g)的△H<0
2SO3(g)的△H<0
B. 在D点时v(正)<v(逆)
C. 若B、C点的平衡常数分别为KB、KC,则KB>KC
D. 恒温恒压下向平衡体系中通入氦气,平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,某科学实验将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。
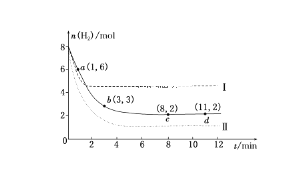
(1)a点正反应速率________(填“大于”“等于”或“小于”)逆反应速率。
(2)下列时间段平均反应速率最大的是________。
A.0~1 min B.1~3 min
C.3~8 min D.8~11 min
(3)平衡时CO2的转化率为________,该条件下的平衡常数K=________。
(4)仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线Ⅰ对应的实验条件改变是________,曲线Ⅱ对应的实验条件改变是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铜-锌-稀硫酸构成的原电池中,当导线中有1mol电子通过时,下列说法正确的是
①锌片溶解了32.5g ②溶液中![]() 向铜片电极移动 ③正极上发生氧化反应产生了H2 ④铜片上逸出0.5molH2
向铜片电极移动 ③正极上发生氧化反应产生了H2 ④铜片上逸出0.5molH2
A.①③B.①④C.②③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大。A能分别与B、C、D三种元素形成电子数相同的分子,且B的最外层电子数是次外层电子数的2倍。E的阳离子、D的阴离子均与氖原子的电子层结构相同,且E的单质与D的单质反应能生成E2D和E2D2两种化合物。F所在主族序数与所在周期序数之差为4。(答题时,请用具体的化学用语表示)
(1)元素B在周期表中的位置__________周期________族;C元素的原子结构示意图_________________。
(2)写出由E、F两种元素形成的离子化合物的电子式________________,C2A4的结构式为:_______________,用电子式表示E2D的形成过程:_____________________。
(3)C、D、E形成的简单离子的半径由大到小的顺序为:_____________________。(用离子符号表示)
(4)E的最高价氧化物对应的水化物与F的最高价氧化物对应的水化物之间发生的化学反应方程式为:______________________________________________________________。
(5)向KI溶液中通入适量的F单质后,再滴加一定量的CCl4,振荡静置后的现象为_____________________________________,继续通入F单质并充分振荡,混合溶液逐渐褪为无色,若1mol还原剂转移10NA电子,上述反应的化学方程式为:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列所示的物质间的转化均能实现的是( )
A.HCl(浓)![]() Cl2
Cl2![]() FeCl3(aq)
FeCl3(aq)
B.Al![]() Al2O3
Al2O3![]() Al(OH)3
Al(OH)3
C.NaCl(熔融)![]() Na
Na![]() NaOH
NaOH
D.N2![]() NO2
NO2![]() HNO3
HNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com