
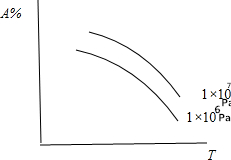
| A. | N2(气)+3H2(气)?2NH3(气);△H<0 | B. | C(固)+CO2(气)?2CO(气);△H>0 | ||
| C. | N2(气)十O2(气)?2N0(气);△H>0 | D. | CaCO3(固)?CaO(固)+CO2(气);△H>0 |
分析 根据“定一议二”原则由图象分析,在相同压强下升高温度,A%(气态反应物)在平衡体系中的百分含量降低,则说明升高温度平衡向正反应方向移动,该反应的正反应为吸热反应,在此基础上进一步分析在相同温度下增大压强,A%(气态反应物)在平衡体系中的百分含量升高,则说明增大压强平衡向逆反应方向移动,该反应逆向为气体体积缩小的方向,据此判断.
解答 解:根据“定一议二”原则由图象分析,在相同压强下升高温度,A%(气态反应物)在平衡体系中的百分含量降低,则说明升高温度平衡向正反应方向移动,该反应的正反应为吸热反应;在此基础上进一步分析,在相同温度下增大压强A%(气态反应物)在平衡体系中的百分含量升高,则说明增大压强平衡向逆反应方向移动,该反应逆向为气体体积缩小的方向;
A.N2(气)+3H2(气)?2NH3(气);△H<0,正向放热,故A错误;
B.C(固)+CO2(气)?2CO(气);△H>0,正向吸热且逆向为气体体积缩小的反应,故B正确;
C.N2(气)十O2(气)?2N0(气);△H>0,正向吸热但反应前后气体体积不变,故C错误;
D.D中反应无气态反应物,即A%(气态反应物)在平衡体系中的百分含量始终为0,故D错误,
故选B.
点评 本题考查根据化学平衡的变化图象,分析温度和压强对平衡移动的影响,题目难度不大,注意曲线的变化趋势,把握平衡移动的各物理量的变化.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃钢是由玻璃纤维和合成树脂组成的材料 | |
| B. | 碳纤维增强复合材料具有韧性好,强度高而质轻的特点 | |
| C. | 硅酸盐材料是新型无机非金属材料 | |
| D. | 有机合成材料易老化,不耐高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
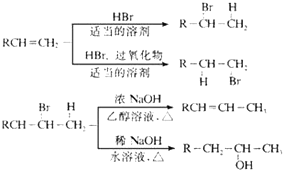
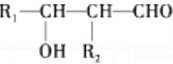
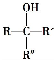 不能被氧化成醛或酮;
不能被氧化成醛或酮;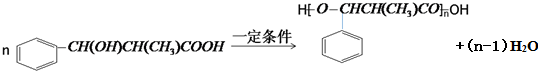
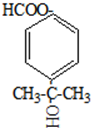 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
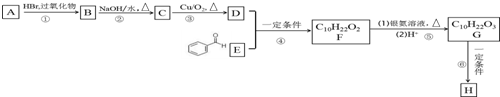
 A、B、C、D、E五种物质中均含有同一种非金属元素,它们能发生如图所示的转化关系,该元素(用R)表示)的单质能与NaOH溶液反应生成盐(Na2RO3)和氢气.
A、B、C、D、E五种物质中均含有同一种非金属元素,它们能发生如图所示的转化关系,该元素(用R)表示)的单质能与NaOH溶液反应生成盐(Na2RO3)和氢气.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
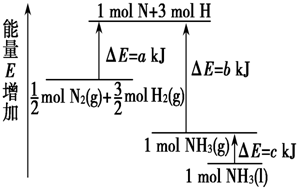
| A. | N2(g)+3H2(g)═2NH3(l)△H=2(a-b-c) kJ•mol-1 | |
| B. | N2(g)+3H2(g)═2NH3(g)△H=2(b-a) kJ•mol-1 | |
| C. | $\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(l)△H=2(b+c-a) kJ•mol-1 | |
| D. | $\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(g)△H=2(a+b) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
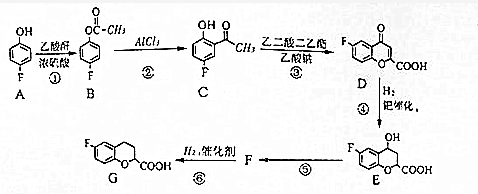
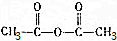 ,请回答下列问题:
,请回答下列问题: .
.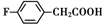 、
、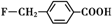 .
.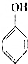 和乙酸酐为原料制备
和乙酸酐为原料制备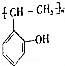 的合成路线流程图(无机试剂任选)
的合成路线流程图(无机试剂任选)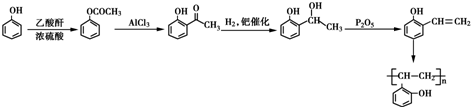 .合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH2CH2Br$→_{△}^{NaOH溶液}$CH2CH2OH.
.合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH2CH2Br$→_{△}^{NaOH溶液}$CH2CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若NO2与O2的体积比是4:3,则此溶液除了硝酸不含其他杂质 | |
| B. | 将一定量的Cu投入溶液中,只产生1.12L(标况)的红棕色气体,则反应的铜有1.6g | |
| C. | 将溶液在强光下光照,产生气泡,溶液变浅黄,产生气泡,则气泡是NO2 | |
| D. | 向浅黄的硝酸中通入氧气,可以使其pH值降低,溶液质量不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com