
【题目】亚氯酸钠(![]() )是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产
)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产![]() 的主要流程如下:
的主要流程如下:
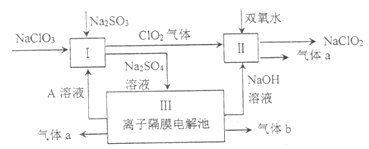
(1)I中发生反应的还原剂是________(填化学式)。
(2)II中反应的离子方程式是_________。
(3)III中离子隔膜电解池的装置如下:
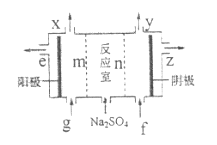
①A的化学式是_________,A在_________口产生。
②m为_______(填“阴”、“阳”)离子交换膜。
③结合化学用语和文字说明解释![]() 产生的原因:_________。
产生的原因:_________。
(4)![]() 是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:
是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备: ![]()
①该反应中氧化剂和还原剂的物质的量之比是_________。
②研究表明:若反应开始时盐酸浓度越大,则气体产物中![]() 的含量越大,运用氧化还原反应规律分析其原因是___________。
的含量越大,运用氧化还原反应规律分析其原因是___________。
(5)![]() 变质可分解为
变质可分解为![]() 和
和![]() 。取等质量变质前后的
。取等质量变质前后的![]() 试样均配成溶液,分别与足量
试样均配成溶液,分别与足量![]() 溶液反应时,消耗
溶液反应时,消耗![]() 的物质的量前者_______(填>、<、=)后者。
的物质的量前者_______(填>、<、=)后者。
【答案】 ![]()
![]()
![]() e 阴 阴极反应为
e 阴 阴极反应为![]() ,反应室中的
,反应室中的![]() 透过阳离子交换膜进入阴极室,和阴极区产生的
透过阳离子交换膜进入阴极室,和阴极区产生的![]() 生成
生成![]() 1:4
1:4 ![]() 的氧化性或
的氧化性或![]() 的还原性随溶液的酸性和浓度的增大而增强,因此
的还原性随溶液的酸性和浓度的增大而增强,因此![]() 被氧化得到
被氧化得到![]() =
=
【解析】(1)由图得到I中将亚硫酸钠转化为硫酸钠,S的化合价由+4+升高为+6,所以还原剂为亚硫酸钠。
(2)II中进入的ClO2转化为NaClO2化合价降低,所以是H2O2中的O化合价升高为O2,方程式为: ![]() 。
。
(3)III中离子隔膜电解池,中间加入硫酸钠溶液,其中阴离子硫酸根离子向阳极移动,所以m是阳离子交换膜。阳极发生的反应为![]() ,氢离子浓度增加,结合穿过m的硫酸根离子得到硫酸,即X为氧气,e为硫酸,加入的g为稀硫酸(主要是为了溶液使导电)。对应的,n为阳离子交换膜,以保证钠离子能向阴极移动,阴极反应为
,氢离子浓度增加,结合穿过m的硫酸根离子得到硫酸,即X为氧气,e为硫酸,加入的g为稀硫酸(主要是为了溶液使导电)。对应的,n为阳离子交换膜,以保证钠离子能向阴极移动,阴极反应为![]() ,生成的氢氧根结合钠离子得到氢氧化钠,所以y为氢气,z为氢氧化钠溶液,加入的f为稀氢氧化钠(主要为了使溶液导电)。结合如上信息得到:
,生成的氢氧根结合钠离子得到氢氧化钠,所以y为氢气,z为氢氧化钠溶液,加入的f为稀氢氧化钠(主要为了使溶液导电)。结合如上信息得到:
①A的化学式是H2SO4,A在e口产生。
②m为阴离子交换膜。
③![]() 产生的原因如上所述。
产生的原因如上所述。
(4)①根据相同元素的相同价态一定直接转化的原理,生成物中的NaCl一定来自反应物的盐酸,NaCl有5个,HCl只有4个,所以有1个NaCl来自NaClO2,另外4个NaClO2转化为ClO2,所以氧化剂为1个NaClO2,还原剂为4个NaClO2,所以该反应中氧化剂和还原剂的物质的量之比是1:4。
②若反应开始时盐酸浓度越大,则气体产物中![]() 的含量越大,说明使用浓盐酸时,会被NaClO2氧化为Cl2,即随着盐酸浓度增大,NaClO2的氧化性增强,或者盐酸的还原性增强。
的含量越大,说明使用浓盐酸时,会被NaClO2氧化为Cl2,即随着盐酸浓度增大,NaClO2的氧化性增强,或者盐酸的还原性增强。
(5)无论![]() 是否变质,最后氧化亚铁离子的时候,都是将亚铁离子氧化为铁离子,Cl最终都是转化为Cl-,变质的反应为3NaClO2 = 2NaClO3 + NaCl,则3molNaClO2转化为2molNaClO3,这2mol NaClO3得电子为2×6e-=12mol电子。如果不变质,3mol NaClO2得电子为3×4e-=12mol电子,所以NaClO2变质前后能得到的电子实际是一样的,能氧化的亚铁离子使相同的。
是否变质,最后氧化亚铁离子的时候,都是将亚铁离子氧化为铁离子,Cl最终都是转化为Cl-,变质的反应为3NaClO2 = 2NaClO3 + NaCl,则3molNaClO2转化为2molNaClO3,这2mol NaClO3得电子为2×6e-=12mol电子。如果不变质,3mol NaClO2得电子为3×4e-=12mol电子,所以NaClO2变质前后能得到的电子实际是一样的,能氧化的亚铁离子使相同的。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应2X(g)+Y2(g)2XY(g);△H<0,达到甲平衡.在仅改变某一条件后,达到乙平衡,下列分析正确的是( )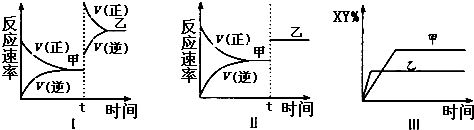
A.图I中,甲、乙的平衡常数分别为K1、K2 , 则K1<K2
B.图Ⅱ中,平衡状态甲与乙相比,平衡状态甲的反应物转化率低
C.图Ⅱ中,t时间是增大了压强
D.图Ⅲ是反应分别在甲、乙条件下达到平衡,说明乙温度高于甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,我国拥有完全自主产权的氢氧燃料电池车在北京奥运会期间为运动员提供服务.某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是( )
A.正极反应式为:O2+2H2O+4e﹣=4OH﹣
B.工作一段时间后,电解液中KOH的物质的量不变
C.该燃料电池的总反应方程式为:2H2+O2=2H2O
D.该电池反应2.24 L H2(标准状况)时,有0.1 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有等体积、等pH的Ba(OH)2、NaOH和NH3H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3 , 则三者的大小关系正确的是( )
A.V3>V2>V1
B.V3=V2=V1
C.V1=V2>V3
D.V3>V2=V1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】你认为下列说法不正确的是( )
A.氢键存在于分子之间,不存在于分子之内
B.对于组成和结构相似的分子,其范德华力随着相对分子质量的增大而增大
C.NH3极易溶于水而CH4难溶于水的原因只是NH3是极性分子,CH4是非极性分子
D.冰熔化时只破坏分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5L 1mol/L FeCl3溶液与0.2L1mol/L KCl溶液中的Cl-的数目之比( )
A. 5:2 B. 15:2 C. 3:1 D. 1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把a mol C2H4跟b mol H2在密闭容器中,在适当条件下,反应达到平衡时生成了p mol C2H6 , 若将所得平衡混合气体混合气体,生成CO2和H2O,所需氧气的物质的量应是( )
A.(3a+0.5b)mol
B.(3a+0.5b)mol
C.(3a+0.5b+3p)mol
D.(3a+0.5b﹣3p)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表中,元素的金属性和非金属性及其强弱比较与周期序数(n)和主族序数(A)有如下经验公式:K= ![]() (K为A与n的比值).下列推理正确的是( )
(K为A与n的比值).下列推理正确的是( )
A.当A一定时,K值越小,则元素的非金属性越强
B.当K=0,则该元素系同一周期中最活泼的金属元素
C.当n一定时,随着K值增大,则元素的非金属性逐渐增强
D.当K=l时,则该元素系过渡元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com