
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知1molSO2(g)氧化为1molSO3(g)的ΔH=-99kJ/mol.
2SO3(g)反应过程的能量变化如图所示。已知1molSO2(g)氧化为1molSO3(g)的ΔH=-99kJ/mol.
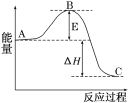
请回答下列问题:
(1)图中A、C分别表示___、___,E的大小对该反应的反应热有无影响?____。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?___,理由是____。
(2)图中ΔH=___kJ/mol.
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:____。
(4)如果反应速率v(SO2)为0.05mol/(L·min),则v(O2)=___mol/(L·min)、v(SO3)=____mol/(L·min)。
(5)已知单质硫的燃烧热为296kJ/mol,计算由S(s)生成3molSO3(g)的ΔH(要求计算过程)。____
【答案】反应物能量 生成物能量 没有影响 降低 因为催化剂改变了反应历程,使活化能E降低 -198 SO2+V2O5=SO3+2VO2、VO2+O2=2V2O5 0.025 0.05 3S(s)+![]() O2(g)=3SO3(g) ΔH=(ΔH1+ΔH2)×3=-1185kJ/mol
O2(g)=3SO3(g) ΔH=(ΔH1+ΔH2)×3=-1185kJ/mol
【解析】
(1) A代表反应物能量、C代表生成物能量;由图像可知E代表活化能,和反应热无关。催化剂能降低反应的活化能,改变了反应的历程,从而加快反应速率。
答案为:反应物能量;生成物能量;降低;因为催化剂改变了反应历程,使活化能E降低
(2) 1 mol SO2(g)氧化为1 mol SO3(g)的ΔH = - 99 kJ/mol,而方程式中二氧化硫是2mol,所以ΔH = - 198 kJ/mol。
答案为:- 198;(3)根据所给元素化合价的变化可写出反应的方程式,SO2+V2O5=SO3+2VO2,4VO2+O2=2V2O5;答案为:SO2 + V2O5=SO3 + 2VO2,4VO2+O2=2V2O5;
(4)因为化学反应速率之比是相应的化学计量数之比,所以v (O2)=0.025mol/(L·min)、v(SO3)=0.05mo/(L·min);
答案为:0.025;0.05;
(5)考查盖斯定律的应用。由反应①2SO2(g)+ O2(g)![]() 2SO3(g) ΔH= - 198 kJ/mol和②S (s)+ O2(g)
2SO3(g) ΔH= - 198 kJ/mol和②S (s)+ O2(g)![]() SO2(g) ΔH= - 296 kJ/mol联立即①+②×2得2S(s)+ 3O2(g)
SO2(g) ΔH= - 296 kJ/mol联立即①+②×2得2S(s)+ 3O2(g)![]() 2SO3(g) ΔH =-790 kJ/mol,所以由S(s)生成3 mol SO3(g)的ΔH =
2SO3(g) ΔH =-790 kJ/mol,所以由S(s)生成3 mol SO3(g)的ΔH =![]() =1185 kJ/mol。
=1185 kJ/mol。
答案为:3S(s)+![]() O2(g)=3SO3(g) ΔH=(ΔH1+ΔH2)×3=-1185kJ/mol
O2(g)=3SO3(g) ΔH=(ΔH1+ΔH2)×3=-1185kJ/mol


科目:高中化学 来源: 题型:
【题目】恒温、恒压下,1 mol A和1 mol B在一个容积可变的容器中发生如下反应:A(g)+2B(g) ![]() 2C(g)。一段时间后达到平衡,生成a mol C。下列说法不正确的是
2C(g)。一段时间后达到平衡,生成a mol C。下列说法不正确的是
A. 起始时刻和达到平衡后容器中的压强比为1:1
B. 物质A、B的转化率之比一定是1:2
C. 若起始放入3 mol A和3 mol B,则达到平衡时生成3a mol C
D. 当v正(A)=v逆(B)时,可断定反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g),下列叙述错误的是
CH3CH2OH(g)+3H2O(g),下列叙述错误的是
A.使用Cu-Zn-Fe催化剂可大大提高生产效率
B.反应需在300℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下氯气和氢气共aL,在光照下充分进行反应,反应后的气体恰好能使bmol 氢氧化钠完全转化成盐,则a、b的关系不可能是下列的( )
A. b<![]() B. b<
B. b<![]() C. b>
C. b>![]() D. b>
D. b>![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度时,水的离子积为KW=1×10-13,则该温度___25℃(填“>”、“<”或“=”)。在此温度下,某溶液中由水电离出来的H+浓度为1×10-10mol/L,则该溶液的pH可能为_____。
(2)若温度为25℃时,体积为Va、pH=a的H2SO4与体积为Vb、pH=b的NaOH混合,恰好中和。已知Va>Vb,且a=0.5b,此溶液中各种离子的浓度由大到小的排列顺序是:____,a的取值范围____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了证明二氧化硫和氯气的漂白性,设计了如下图所示的实验装置:
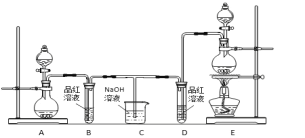
他们制备二氧化硫和氯气所依据的原理分别是:
Na2SO3+H2SO4 = Na2SO4+H2O+SO2↑
MnO2+4HCl(浓) ![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(1)用来制取氯气的装置是______(填字母),反应中浓盐酸所表现出________________性质。
(2)反应开始一段时间后,B、D试管中的品红溶液均退色。停止通气后,再给B、D两个试管分别加热____ (填" B”或“D")试管中无明显现象。
(3)装置C的作用是________________________;
(4)若装置D中的品红溶液换成紫色的石蕊溶液,则出现的现象是____________________________;
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不退色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在50 mL 4 mol·L-1的氢氧化钠溶液中,通入一定量的硫化氢,反应完毕,在常温减压条件下,用氮气把溶液吹干,得到白色固体7.92 g,通过计算确定白色固体的组成及各组分的质量。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.凡是放热反应都是自发的,凡是吸热反应都是非自发的
B.常温下反应 C(s)+CO2(g)![]() 2CO(g)不能自发进行,该反应的ΔH>0
2CO(g)不能自发进行,该反应的ΔH>0
C.自发反应的现象一定非常明显,非自发反应的熵一定减小
D.反应(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) ΔH=+74.9kJ·mol-1在高温不能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为铝热反应的实验装置,请回答下列问题:
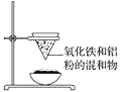
(1)该实验装置中还缺________,引发铝热反应的操作为_______。
(2)若将氧化铁换成氧化镁,该反应____(填“能”或“不能”)发生,理由是______。
(3)铝热反应的用途有哪些__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com