
| A、常温常压下,28g以任意比组成的CO与N2混合气体中含有2NA个原子 |
| B、分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |
| C、常温常压下,1.06gNa2CO3含有的Na+离子数为0.02NA |
| D、标准状况下,11.2L H2O与8.5gNH3所含分子数相等 |
| 28g |
| 28g/mol |


科目:高中化学 来源: 题型:
| A、2Na2O2+2Mn2O7=4NaMnO4+O2↑ |
| B、2Na2O2+2N2O3=4NaNO2+O2 |
| C、2Na2O2+2N2O5=4NaNO3+O2↑ |
| D、Na2O2+2NO2=2NaNO3+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3 NaHCO3 NaCl NH4Cl |
| B、NaHCO3 Na2CO3 NH4Cl NaCl |
| C、(NH4)2SO4 NH4Cl NaNO3 Na2S |
| D、NH4Cl (NH4)2SO4 Na2S NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
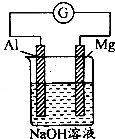 将Mg条、Al条平行插入一定浓度的NaOH溶液中(如图所示连接).此电池工作时,下列叙述正确的是( )
将Mg条、Al条平行插入一定浓度的NaOH溶液中(如图所示连接).此电池工作时,下列叙述正确的是( )| A、Mg比Al活泼,失去电子被氧化成Mg2+ |
| B、Al条在反应中逐渐变细 |
| C、该电池的外电路中,电子由Mg极流出,Al极流入 |
| D、消耗24gMg,电路中将转移2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、燃烧热只针对可燃物和氧气反应而言 |
| B、中和热只针对强酸与强碱反应而言 |
| C、溶解平衡只针对难溶物而言 |
| D、电解池只针对自发进行的氧化还原反应而言 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放热反应的反应速率总是大于吸热反应的反应速率 |
| B、已知一定条件下石墨转化为金刚石吸收热量,则石墨比金刚石稳定 |
| C、对于吸热反应,生成物总能量一定低于反应物总能量 |
| D、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2S2O3溶液中加入稀硫酸:2S2O32-+2H+=SO42-+3S↓+H2O |
| B、向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -=2 Al(OH)3↓+3BaSO4↓ |
| C、盐碱地(含较多NaCl、Na2CO3)中加入石膏,降低土壤的碱性,涉及的方程式为Ca2++CO32-=CaCO3↓ |
| D、在海带灰的滤液中加入几滴稀硫酸,再加入双氧水,即能使淀粉溶液变蓝2I-+H2O2+2H+=I2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2与水反应:Na2O2+H2O=2Na++2OH-+O2↑ | ||||
B、用惰性电极电解MgCl2溶液:2Cl-+2H2O
| ||||
| C、Ba(OH)2溶液中加入过量的NaHSO4溶液:Ba2++SO42-+OH-+H+=BaSO4↓+H2O | ||||
| D、硫酸亚铁溶液中加入酸化的双氧水:2Fe2++2H++H2O2=2Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com