
分析 (1)0.3mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5KJ的热量,则1mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出2165KJ的热量;根据盖斯定律写出其热化学反应方程式,后根据物质的物质的量与反应放出的热量成正比来解答;
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式,反应的热化学方程式改变系数,焓变随之改变,通过热化学方程式之间的加减计算得到;
(3)氢氧燃料电池中,H2从负极通入,在反应中被氧化,正极上是氧气发生得电子的还原反应,又因为电解质是KOH溶液,不会在电极反应中出现H+;负极上是甲烷发生失电子的氧化反应,正极上是氧气发生得电子的还原反应,又因为电解质是KOH溶液,不会在电极上放出二氧化碳.
解答 解:(1)0.3mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5KJ的热量,则1mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出2165KJ的热量,反应的热化学方程式为:B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165kJ/mol,①B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165kJ/mol,②H2O(l)→H2O(g);△H=+44kJ/moL,
由盖斯定律可知①+②×3得:B2H6(g)+3O2(g)═B2O3(s)+3H2O(g)△H=-2033kJ/mol,11.2L(标准状况)即0.5mol乙硼烷完全燃烧生成气态水时放出的热量是2033kJ×0.5=1016.5kJ,
故答案为:B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165kJ/mol;1016.5.
(2))①N2(g)+O2(g)=2NO2(g)△H1=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ/mol
依据盖斯定律:②×2-①得到:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol;
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol;
(3)氢氧燃料电池以KOH溶液为电解质溶液时,正极上是氧气发生得电子的还原反应,即O2+2H2O+4e-=4OH-,负极上是甲烷发生失电子的氧化反应,又因为电解质是KOH溶液,二氧化碳和氢氧化钾反应得到的是碳酸钾,即CH4+10OH--8e-=CO32-+7H2O,故答案为:O2+2H2O+4e-=4OH-;CH4+10OH--8e-=CO32-+7H2O.
点评 本题考查了热化学方程式的书写方法、盖斯定律的计算应用以及燃料电池的工作原理、电极反应式的书写知识,题目较简单,注意知识的归纳和梳理是关键.


科目:高中化学 来源: 题型:选择题
| A. | 明矾用于净水与K+、Al3+的水解有关 | |
| B. | 配制FeCl3溶液时,为了抑制Fe3+的水解,常加入少量稀硫酸 | |
| C. | 常常用排饱和食盐水的方法收集氯气,可以避免氯气溶于水而损失 | |
| D. | 将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (R、R’代表烃基)
(R、R’代表烃基) .
. .
. 与足量NaOH溶液反应时,最多消耗4mol NaOH
与足量NaOH溶液反应时,最多消耗4mol NaOH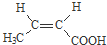 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 放入0.2mol SO2、0.1molO2、0.1mol SO3,达到平衡时SO3必小于amol | |
| B. | 放入0.2mol SO2、0.1molO2、0.2mol SO3,达到平衡时SO3必大于amol | |
| C. | 放入0.4mol SO2、0.1molO2,达到平衡时SO3会等于0.4amol | |
| D. | 放入0.2mol SO2、0.1molO2,达到平衡时SO3必小于amol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 0.01mol/L KIO3溶液的体积/mL | Na2SO3溶液的体积/mL | H2O的 体积/mL | 实验温度/℃ | 溶液出现蓝色所需的时间 | |
| 实验1 | 5 | 5 | V1 | 0 | a |
| 实验2 | 5 | 5 | 40 | 25 | b |
| 实验3 | 5 | V2 | 35 | 25 | c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO3(aq)+KOH(aq)═H2O(l)+KNO3(aq)△H>-57.3kJ/mol. | |
| B. | HNO3(aq)+NH3•H2O(aq)═H2O(l)+KNO3(aq)△H<-57.3kJ/mol. | |
| C. | CH3COOH(aq)+KOH(aq)═H2O(l)+CH3COOK(aq)△H<-57.3kJ/mol. | |
| D. | CH3COOH(aq)+NaOH(aq)═H2O(l)+CH3COONa(aq)△H>-57.3kJ/mol. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com