
| A. | c(Z)=0.45mol/L | B. | c(Y2)=0.5mol/L | C. | c(X2)=0 | D. | c(X2)=0.5mol/L |
分析 该反应可能向正反应方向移动也可能向逆反应方向移动,如果向正反应方向移动,则反应物浓度最小、生成物浓度最大,如果向逆反应方向移动,则反应物浓度最大、生成物浓度最小,采用极限法分析解答.
解答 解:该反应可能向正反应方向移动也可能向逆反应方向移动,如果向正反应方向移动,则反应物浓度最小、生成物浓度最大,如果向逆反应方向移动,则反应物浓度最大、生成物浓度最小,
假设Y2完全转化为Z,完全反应后则c(Y2)=0、c(X2)=(0.2-0.15)mol/L=0.05mol/L、c(Z)=0.3mol/L+0.15mol/L=0.45mol/L;
假设Z完全转化为生成物,完全反应后c(Z)=0、c(Y2)=0.3mol/L+0.6mol/L=0.9mol/L、c(X2)=(0.2+0.3)mol/L=0.5mol/L,
实际上存在平衡状态,所以c(X2)为0.05mol/L-0.5mol/L、c(Y2)为0-0.9mol/L、c(Z)在0-0.45mol/L,
所以只有B符合,故选B.
点评 本题考查化学平衡建立过程,明确可逆反应特点是解本题关键,利用极限法分析解答即可,题目难度不大.


科目:高中化学 来源: 题型:解答题
 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0.00 | 26.15 |
| 第二次 | 25.00 | 0.56 | 30.30 |
| 第三次 | 25.00 | 0.20 | 26.35 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v=0.10 mol•L-1•s-1是指1 s内某物质的物质的量浓度为0.10 mol•L-1 | |
| B. | 对于任何化学反应来说,反应速率越快,反应现象就越明显 | |
| C. | 化学反应速率只是对可逆反应才适用 | |
| D. | 根据反应速率的大小,可以知道反应进行的相对快慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径 A>B>D>C | B. | 原子序数 d>c>b>a | ||
| C. | 离子半径 C>D>B>A | D. | 单质的还原性 A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只用一种试剂就可以鉴别甲苯、乙醇和四氯化碳 | |
| B. | 若两种烃中碳、氢元素的质量分数分别相同,它们必定是同系物 | |
| C. | CH3-CH=CH2分子中所有原子一定处于同一平面 | |
| D. | 某烷烃的命名为3,4,4-三甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数:c>d | B. | 离子的还原性:Y2->Z- | ||
| C. | 氢化物的稳定性:H2Y>HZ | D. | 原子半径:X<W |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 周期 族 | I | II | III | IV | V | VI | VII | O |
| 二 | C | F | ||||||
| 三 | Na | Mg | Al | Si | S | Cl | Ar |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
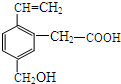 某有机物的结构如图所示,这种有机物可能具有的性质是( )
某有机物的结构如图所示,这种有机物可能具有的性质是( )| A. | 只有②④ | B. | 只有②③④ | C. | 只有①②③④⑤ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com