
【题目】将5.5g铁铝混合物粉末加入过量的1L1mol/L HNO3溶液中,充分反应后,得3.36L(标准状况)NO气体,求
(1)假设反应前后溶液的体积不变,剩余硝酸的浓度为mol/L
(2)混合物中铝的质量分数为%,
(3)向反应后的溶液中加入mL 1mol/L NaOH溶液时,生成的沉淀量最大,再加mL 1mol/L NaOH溶液才能使沉淀的量不再发生变化.
【答案】
(1)0.4
(2)49.1
(3)850;100
【解析】解:(1)同质量的铝消耗硝酸的量多,假设5.5g金属全部是铝,由Al+4HNO3=Al(NO3)3+NO↑+2H2O,可知需要硝酸 ![]() ×4=0.81 mol,硝酸物质的量为1L×1mol/L=1mol>0.81 mol,所硝酸过量,设铝、铁的物质的量分别为:xmol、ymol,根据质量守恒得27x+56y=5.5;得失电子守恒得(硝酸过量铁变成三价铁):3x+3y=
×4=0.81 mol,硝酸物质的量为1L×1mol/L=1mol>0.81 mol,所硝酸过量,设铝、铁的物质的量分别为:xmol、ymol,根据质量守恒得27x+56y=5.5;得失电子守恒得(硝酸过量铁变成三价铁):3x+3y= ![]() ×3,联立方程解得:x=0.1 y=0.05,所以消耗硝酸的物质的量为:(0.1+0.05)×3+
×3,联立方程解得:x=0.1 y=0.05,所以消耗硝酸的物质的量为:(0.1+0.05)×3+ ![]() =0.6mol,所以剩余硝酸的物质的量1mol﹣0.6mol=0.4mol,所以剩余硝酸的浓度为
=0.6mol,所以剩余硝酸的物质的量1mol﹣0.6mol=0.4mol,所以剩余硝酸的浓度为 ![]() =0.4mol/l, 所以答案是:0.4;(2)铝的质量分数为:
=0.4mol/l, 所以答案是:0.4;(2)铝的质量分数为: ![]() ×100%=49.1%,所以答案是:49.1;(3)要使沉淀的量不随NaOH溶液量的变化而变化,则最终溶液中溶质为NaNO3、NaAlO2 , 根据钠离子守恒:n(NaOH)=n(NaNO3)+n(NaAlO2),再结合N原子、Al原子守恒,n(NaOH)=1mol﹣
×100%=49.1%,所以答案是:49.1;(3)要使沉淀的量不随NaOH溶液量的变化而变化,则最终溶液中溶质为NaNO3、NaAlO2 , 根据钠离子守恒:n(NaOH)=n(NaNO3)+n(NaAlO2),再结合N原子、Al原子守恒,n(NaOH)=1mol﹣ ![]() +0.1mol=0.95mol,此时需要氢氧化钠溶液体积为
+0.1mol=0.95mol,此时需要氢氧化钠溶液体积为 ![]() =0.95L=950mL;
=0.95L=950mL;
要使生成的沉淀量最大,最后得到的溶液是中溶质为NaNO3 , 根据钠离子守恒:n(NaOH)=n(NaNO3)=1mol﹣ ![]() =0.85mol,此时需要氢氧化钠溶液体积为
=0.85mol,此时需要氢氧化钠溶液体积为 ![]() =0.85L=850mL,所以再加入950mL﹣850mL=100mL,
=0.85L=850mL,所以再加入950mL﹣850mL=100mL,
所以答案是:850;100.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列转化不属于煤或石油的综合利用的是( )
A.将煤干馏制得煤焦油和焦炭
B.在一定条件下将煤与氢气转化为液体燃料
C.将煤变为煤饼作燃料
D.将石油裂解制得乙烯等化工原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一个10 L密闭容器中发生某可逆反应,其平衡常数表达式为K=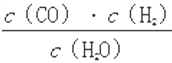 。请回答下列问题。
。请回答下列问题。
(1)若温度升高,K增大,则该反应是________反应(填“吸热”或“放热”)。
(2)能判断该反应一定达到平衡状态的是________(填字母序号)。
A.v正(H2O)=v逆(H2)
B.容器中气体的平均相对分子质量不随时间改变
C.消耗n mol H2的同时消耗n mol CO
D.容器中物质的总物质的量不随时间改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
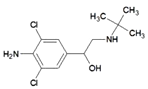
A. 瘦肉精学名盐酸克伦特罗,结构如右图,可以发生取代、加成、水解、酯化、消去反应
B. C3H7OH与C4H9OH分子间脱水,最多可生成6种醚
C. 1mol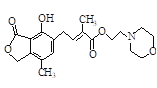 最多可与含4mol NaOH的水溶液完全反应
最多可与含4mol NaOH的水溶液完全反应
D. 某油脂的化学式为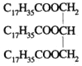 ,它既属于酯类又属于高分子化合物
,它既属于酯类又属于高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组为了测定某(CuCl22H2O)样品的纯度,设计了如下方案:称取1.0 g样品溶解于适量水中,向其中加入含AgNO3 2.38 g的AgNO3溶液(溶液中除Cl-外,不含其他与Ag+反应生成沉淀的离子),Cl-即被全部沉淀。然后用含Fe3+的溶液作指示剂,用0.2 mol·L-1的KSCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定样品的纯度。请回答下列问题:
(1)判断滴定达到终点的现象是___________________。
(2)在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n(Cl-)的测定结果_____________(选填“偏高”、“偏低”或“无影响”)。
(3)若到达滴定终点时,用去KSCN标准溶液20.00mL,求此样品的纯度__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将浓度和体积均相同的一元酸HA与一元碱BOH混合,所得溶液呈酸性。下列判断正确的是
A.HA一定不是弱酸B.BOH一定不是强碱
C.HA一定是强酸D.BOH一定是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1LMgSO4和CuSO4的混合液中c(SO42-)= 2mol/L,用石墨电极电解此溶液,通电一段时间,两极上均产生22.4L(标准状况)气体,则原混合液中Mg2+的浓度是( )
A. 0.5mol/L B. 1mol/L C. 1.5mol/L D. 2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的KOH溶液时,导致浓度偏低的原因可能是( )
A.容量瓶中原有少量的蒸馏水
B.移液时,不慎将液体流到瓶外
C.容量瓶盛过KOH溶液,使用前未洗涤
D.定容时俯视刻度线和液面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com