
| A、氢氧化钡晶体和氯化铵晶体的反应 |
B、能量变化如图所示的反应 |
| C、化学键断裂吸收的热量比化学键生成放出的热量多的反应 |
| D、燃烧反应和中和反应 |
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
A、甲基的电子式: | ||
B、乙烯的比例模型: | ||
C、质子数为53,中子数为78的碘原子:
| ||
| D、次氯酸的结构式:H─O─Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子交换膜在工业生产中广泛应用,如氯碱工业使用了阴离子交换膜 | ||
| B、人造纤维可利用竹子、棉花、麻类的纤维材料制成,而合成纤维是利用自然界的非纤维材料(如石油、煤)通过化学合成方法得到 | ||
| C、有机玻璃是以有机物A(甲基丙烯酸甲酯)为单体,通过加聚反应得到,合成A的一种途经是: CH3C≡CH+CO+CH3OH
 ,其过程符合绿色化学的原则 ,其过程符合绿色化学的原则 | ||
| D、温室效应导致海水的酸度增加,珊瑚、贝壳类等生物的生存将会受到威胁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2L的戊烷所含的分子数为0.5NA |
| B、28g乙烯所含共用电子对数目为4NA |
| C、1mol甲基的电子数目为7NA |
| D、现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、 |
C、 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①⑤⑥⑦ | B、只有⑥ |
| C、②③⑤⑥ | D、①②⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2,I2,HI三种物质的浓度一定相等 |
| B、H2,I2全部反应生成了HI |
| C、H2,I2,HI三种物质的浓度保持不变 |
| D、反应中正反应速率逐渐减小,最后减小为零 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤⑥ | B、③④⑤⑥ |
| C、②④⑤⑥ | D、①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、硫原子的原子结构示意图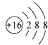 | ||
B、NH4Cl的电子式: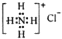 | ||
C、原子核内有10个中子的氧原子:
| ||
| D、基态铜原子的电子排布式为:1s22s22p63s23p63d94s2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com