
| A. | 两元素必在同一周期 | B. | 两元素可能在相邻两周期 | ||
| C. | 两元素不可能同为金属元素 | D. | 两元素不可能同主族 |
分析 有三种短周期元素,最外层电子数之和为17,质子数之和为31.如果这三种元素中有一种是氩元素,Ar原子最外层电子数是8、质子数是18,则另外两种元素最外层电子数是9、质子数之和是13,根据原子结构分析解答.
解答 解:有三种短周期元素,最外层电子数之和为17,质子数之和为31.如果这三种元素中有一种是氩元素,Ar原子最外层电子数是8、质子数是18,则另外两种元素最外层电子数是9、质子数之和是13,
两种原子最外层电子数一个大于4.5一个小于4.5,质子数一个大于6.5一个小于6.5,
符合条件的有Li和Ne、Be和F、B和O、C和N元素,
A.通过以上分析知,这两种元素必须位于同一周期,故A正确;
B.根据以上分析知,两种元素必须位于同一周期,故B错误;
C.通过以上分析知,两种元素不可能都是金属元素,故C正确;
D.通过以上分析知,两种元素不可能位于同一主族,故D正确;
故选B.
点评 本题考查元素周期表及原子结构,为高频考点,侧重考查学生分析判断及总结归纳能力,明确原子结构、元素周期表结构是解本题关键,利用平均法结合原子结构分析解答,题目难度不大.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | b=a+34 | B. | a=b-11 | C. | b=a+25 | D. | a=b-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;由A和B形成的原子个数为1:1的化合物中阴阳离子个数比为1:1.
;由A和B形成的原子个数为1:1的化合物中阴阳离子个数比为1:1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 | |
| B. | 原子核外M层上有5个电子的X原子与原子核外N层上有5个电子的Y原子 | |
| C. | 2p轨道上有一个未成对电子的X原子与3p轨道上有一个未成对电子的Y原子 | |
| D. | 最外层都只有一个电子的X、Y原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度均为0.2 mol•L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 | |
| B. | 将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液中,先产生Ag2CrO4沉淀 | |
| C. | c(Mg2+)为0.11 mol•L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上 | |
| D. | 在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
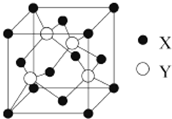 元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z的原子最外层电子数是其内层的3倍.
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z的原子最外层电子数是其内层的3倍.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅不与酸溶液反应,可用石英器皿盛放氢氟酸 | |
| B. | 分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 | |
| C. | 石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 | |
| D. | 将过量的CO2通入次氯酸钙溶液可生成次氯酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com