
【题目】元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是______。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.单质的熔点降低
d.氧化物对应的水化物碱性减弱,酸性增强
原子最外层电子数与次外层电子数相同的元素名称为_____,氧化性最弱的简单阳离子是____。
(2)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是_____;制铝时,电解Al2O3而不电解AlCl3的原因是_____。
(3)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗)![]() SiCl4
SiCl4![]() SiCl4(纯)
SiCl4(纯)![]() Si(纯)
Si(纯)
写出SiCl4的电子式:_____;
(4)下列气体不能用浓硫酸干燥,可用P2O5干燥的是_____。
a.NH3 b.HI c.SO2 d.CO2
(5)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:____。
【答案】b 氩 Na+ MgO熔点高,耗能大 AlCl3是共价化合物,熔融状态不导电 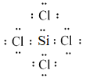 b 4KClO3
b 4KClO3![]() KCl+3KClO4
KCl+3KClO4
【解析】
第三周期元素包括Na、Mg、Al、Si、P、S、Cl、Ar。根据同周期元素性质的递变性和原子结构解答(1);根据表格给出的信息,结合实际生产解答(2);SiCl4和CCl4结构相似,据此可以解答(3);浓硫酸不能干燥碱性和还原性气体,P2O5不能干燥碱性气体;根据氧化还原反应规律和氯元素的化合价书写KClO3分解的化学方程式。
(1) a.同周期元素从左到右,核电荷数逐渐增多,对核外电子的束缚力逐渐增强,所以原子半径逐渐减小;阳离子Na+、Mg2+、Al3+半径逐渐减小,阴离子半径也逐渐减小,但由于阴离子比阳离子多一个电子层,所以阳离子半径小于阴离子半径,故a错误;
b.同周期元素从左到右,核电荷数逐渐增多,对核外电子的束缚力逐渐增强,所以金属性减弱,非金属性增强,故b正确;
c.Na、Mg、Al三种金属单质的熔点逐渐升高,Si、P、S、Cl对应的四种单质的熔点逐渐降低,故c错误;
d.同周期元素从左到右,最高价氧化物对应的水化物碱性减弱,酸性增强,非最高价氧化物对应水化物的递变不完全符合此规律,如H2SO3的酸性强于HClO,故d错误;
故选b。
第三周期原子的次外层电子数是8,原子最外层电子数与次外层电子数相同,则为Ar,元素名称为氩。Na单质的还原性最强,则Na+的氧化性最弱。
(2) MgCl2 和MgO都是离子化合物,熔融状态下都能导电,但MgO熔点高,加热到熔融状态需要消耗更多的能量,所以工业制镁时,电解MgCl2而不电解MgO;制铝时,只能电解熔融的Al2O3,因为AlCl3是共价化合物,熔融状态时不导电。
(3)SiCl4和CCl4结构相似,Si原子和每个Cl原子都共用一对电子,在SiCl4分子中每个原子都达到了8电子稳定结构,电子式为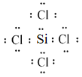 。
。
(4)NH3是碱性气体,既不能用浓硫酸干燥,也不能用P2O5干燥;HI具有还原性,会被浓硫酸氧化,不能用浓硫酸干燥,但由于HI是酸性气体,可以用P2O5干燥;SO2虽然有还原性,但由于和浓硫酸里的硫价态相邻,所以不能被浓硫酸氧化,可以用浓硫酸干燥,也可以用P2O5干燥;CO2是酸性气体,既可以用浓硫酸干燥,也可以用P2O5干燥,故选b。
(5)KClO3 400℃时分解只生成两种盐,其中一种是无氧酸盐为KCl,氯元素的化合价从+5降低到-1价,则生成的另一种盐中氯的化合价应该升高到+7价,而且盐中阴阳离子个数比为1:1,所以是KClO4,根据电子守恒配平反应方程式:4KClO3![]() KCl+3KClO4。
KCl+3KClO4。


科目:高中化学 来源: 题型:
【题目】(1)Cu与浓硫酸反应制备![]() 的实验探究。
的实验探究。
①写出Cu与浓硫酸反应的化学方程式:___________________________
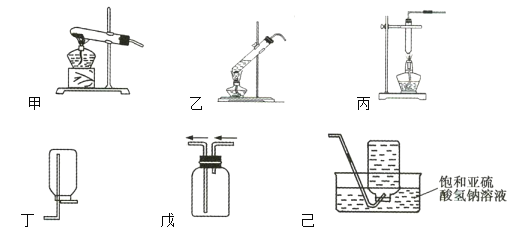
②如图所示,气体发生装置选取____________(填“甲”“乙”或“丙”),气体收集装置选取_______________________________________(填“丁”“戊”或“己”)。
(2)Zn与浓硫酸反应生成气体的实验探究。
结合实验室制备H2的反应,某实验小组猜想Zn与浓硫酸反应的气体生成物中含有H2杂质。该小组同学利用下列装置对Zn与浓硫酸反应生成的气体混合物进行实验探究:
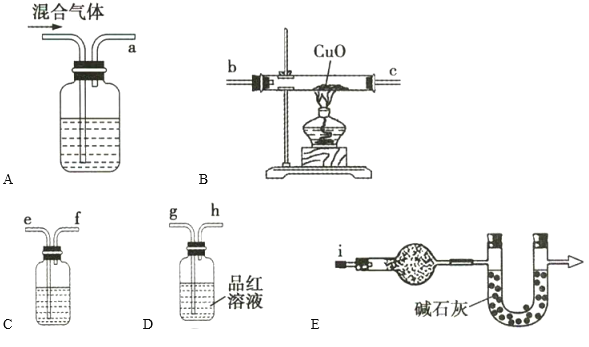
①装置的正确连接顺序为a→ ______________________________ 。
②装置A中盛有浓NaOH溶液,实验开始时,该装置中发生反应的离子方程式为______________________________。
③如果混合气体中含有足量的H2,则装置B中的现象是______________________________ 。
④装置C中盛装的试剂名称是______________________________ 。装置D的作用是______________________________ 。
⑤通过装置E的球形干燥管中盛有的试剂所产生的现象,可推断出Zn与浓硫酸反应生成的气体混合物中含有H2,该球形干燥管中盛装的试剂的化学式为______________________________,现象为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A.碳酸钠的水解反应CO32-+H2O=HCO3-+OH -
B.碳酸氢钙与过量的NaOH溶液反应Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
C.苯酚钠溶液与二氧化碳反应C6H5O-+CO2+H2O=C6H5OH+CO32-
D.稀硝酸与过量的铁屑反应3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硅元素的化合物广泛存在于自然界中,与其他矿物共同构成岩石。晶体硅(熔点1410℃)用途广泛,制取与提纯方法有多种。
(1)炼钢开始和结束阶段都可能发生反应: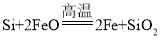 ,其目的是________。
,其目的是________。
A.得到副产品硅酸盐水泥 B.制取SiO2,提升钢的硬度
C.除去生铁中过多的Si杂质 D.除过量FeO,防止钢变脆
(2)一种由粗硅制纯硅过程如下:![]() 在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式:_______。对于钠的卤化物(NaX)和硅的卤化物(SiX4)下列叙述正确的是(_________)
在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式:_______。对于钠的卤化物(NaX)和硅的卤化物(SiX4)下列叙述正确的是(_________)
A.NaX易水解 B.SiX4是共价化合物
C.NaX的熔点一般高于SiX4 D.SiF4晶体是由共价键形成的空间网状结构
(3)粗硅经系列反应可生成硅烷(SiH4),硅烷分解也可以生成高纯硅。硅烷的热稳定性弱于甲烷, 所以Si元素的非金属性弱于C元素,用原子结构解释其原因:_______。
(4)此外,还可以将粗硅转化成三氯氢硅(SiHCl3),通过反应:SiHCl3(g)+H2(g)![]() Si(s)+3HCl(g)制得高纯硅。不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如图所示。下列说法正确的是(__________)(填字母序号)。
Si(s)+3HCl(g)制得高纯硅。不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如图所示。下列说法正确的是(__________)(填字母序号)。
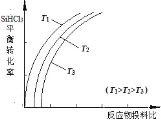
a.该反应的平衡常数随温度升高而增大
b.横坐标表示的投料比应该是![]()
c.实际生产中为提高SiHCl3的利用率,可适当降低压强
(5)硅元素最高价氧化物对应的水化物是H2SiO3。室温下,0.1mol/L的硅酸钠溶液和0.1mol/L的碳酸钠溶液,碱性更强的是_______,其原因是_______。
已知:H2SiO3:Ki1=2.0×10-10,Ki2=1.0×10-12;H2CO3:Ki1=4.3×10-7,Ki2=5.6×10-11。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨在一定条件下转化为金刚石,其能量变化如图所示,其中ΔE1=393.5 kJ,ΔE2=395.4 kJ,下列说法正确的是

A. 1 mol石墨完全转化为金刚石需吸收1.9 kJ的能量
B. 石墨转化为金刚石属于物理变化
C. 金刚石的稳定性强于石墨的
D. 1 mol金刚石的能量大于1 mol CO2的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在探究影响化学反应速率的因素时,将H2C2O4溶液滴入KMnO4酸性溶液中,一段时间后,溶液突然变成无色,发生反应:KMnO4+H2C2O4+H2SO4![]() K2SO4+MnSO4+CO2+H2O(没有配平)。下列有关说法错误的是
K2SO4+MnSO4+CO2+H2O(没有配平)。下列有关说法错误的是
A. H2C2O4中C的化合价为+3
B. 每生成22.4 L(标况)CO2,转移电子2 mol
C. 该反应中,氧化剂与还原剂物质的量之比为2 :5
D. 溶液突然褪色的原因是产物MnSO4对该反应有催化作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用滴有酚酞和氯化钠溶液湿润的滤纸分别做甲、乙两个实验,下列判断错误的是( )

A.b极附近有气泡冒出B.d极附近出现红色
C.a、c极上都发生氧化反应D.甲中铁棒比乙中铁棒更易腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化工生产原理的叙述中,不符合目前工业生产实际的是
A.硫酸工业中,三氧化硫在吸收塔内被水吸收制成浓硫酸
B.炼铁工业中,用焦炭和空气反应产生的一氧化碳在高温下还原铁矿石中的铁
C.合成氨工业中,用铁触媒作催化剂,可提高单位时间氨的产量
D.氯碱工业中,电解槽的阴极区产生NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是无色具有水果香味的液体,沸点为 77.2 ℃,实验室某次制取乙酸乙酯用冰醋酸、乙醇、浓硫酸、饱和碳酸钠溶液以及极易与乙醇结合的氯化钙溶液。主要装置如下图所示:
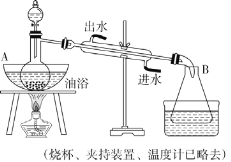
实验步骤:
①先向 A 中的蒸馏烧瓶中注入少量乙醇和浓硫酸后摇匀,再将剩下的所有乙醇和冰醋酸注入分液漏斗里待用。
②加热油浴保温。
③将分液漏斗中的液体缓缓滴入蒸馏烧瓶里,
调节加入速率,使蒸出酯的速率与进料速率大体相等,直到加料完成。
④保持油浴温度一段时间,至不再有液体馏出后,停止加热。
⑤取下 B 中的锥形瓶,将一定量饱和 Na2CO3 溶液分批少量多次地加到馏出液里,边加边振荡,至无气泡产生为止。
⑥将⑤的液体混合物用分液漏斗分液,弃去水层。
⑦将饱和 CaCl2 溶液(适量)加入分液漏斗中,振荡一段时间后静置,放出水层(废液)。
⑧分液漏斗里得到的是初步提纯的乙酸乙酯粗品。
(1)实验中浓硫酸的主要作用是_____。
(2)用饱和 Na2CO3 溶液洗涤粗酯的目的是_____。用饱和 CaCl2溶液洗涤粗酯的目的是_____。
(3)在步骤⑧所得的粗酯里还含有的杂质是_____。
(4)写出本实验制取乙酸乙酯的化学方程式:_____。
(5)若用 46g 乙醇与 30g 醋酸反应,如果实际产率是理论产率的 65%,试计算可得到的乙酸乙酯的质量为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com