
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。工业上可通过以下反应制得ClO2(提示:下面方程式中的氧元素都为负二价)2KClO3+Na2SO3+H2SO4![]() 2ClO2↑+K2SO4+Na2SO4+H2O,则下列说法中正确的是
2ClO2↑+K2SO4+Na2SO4+H2O,则下列说法中正确的是
A. KClO3在反应中是还原剂
B. 制得1mol的ClO2反应中需转移2mol电子
C. Na2SO3的还原性小于ClO2的还原性
D. 反应中被氧化的元素是S
【答案】D
【解析】
反应2KClO3+Na2SO3+H2SO4![]() 2ClO2↑+K2SO4+Na2SO4+H2O中,Cl元素的化合价由+5降低为+4价,S元素的化合价由+4升高到+6价,以此来解答。
2ClO2↑+K2SO4+Na2SO4+H2O中,Cl元素的化合价由+5降低为+4价,S元素的化合价由+4升高到+6价,以此来解答。
A.因氯酸钾中Cl元素的化合价由+5降低为+4价,KClO3在反应中得到电子,则KClO3在反应中是氧化剂,故A错误;
B.氯酸钾中Cl元素的化合价由+5降低为+4价,得到1个电子,则制得1mol的ClO2反应中需转移1mol电子,故B错误;
C.亚硫酸钠在反应中作还原剂,根据还原剂的还原性强于还原产物的还原性可知Na2SO3的还原性强于ClO2的还原性,故C错误;
D.亚硫酸钠中S元素的化合价由+4升高到+6价,失去电子,发生氧化反应,被氧化的元素是S,故D正确;
故答案选D。


科目:高中化学 来源: 题型:
【题目】在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子.
(1)写出基态E原子的价电子排布式 .
(2)B、C、D三元素第一电离能由小到大的顺序为(用元素符号表 示) ;A与C形成CA3型分子,分子中C原子的杂化类型为 ,分子的立体结构为 ;C的单质与 BD化合物是等电子体,据等电子体的原理,写出BD化合物的电子式 ; A2D由液态形成晶体时密度 (填增大,不变或减小),分析主要原因(用文字叙述)
(3)已知D、F能形成一种化合物,其晶胞的结构如图所示,则该化合物的化学式为(用元素符号表示) ;若相邻D原子和F原子间的距离为a cm,阿伏伽德罗常数为NA,则该晶体的密度为 g/cm3(用含a、NA的符号表示).

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。某工厂设计下列流程图,完成回收硫酸亚铁和铜的简单实验方案。
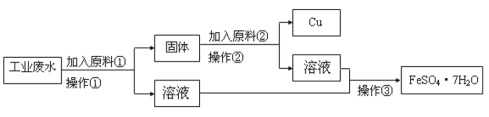
(1)操作①的名称为______,该操作所需要的玻璃仪器为______、_____、烧杯。
(2)原料②的化学式为__________,发生的离子方程式为_________________。
(3)为验证上述流程图中的溶液中含有SO42-:取少量的溶液于试管中,先加入______,再加入________,若观察到有__________,则说明溶液中含有SO42-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室通常采用以下装置来制备纯净干燥的氯气,回答下列问题:
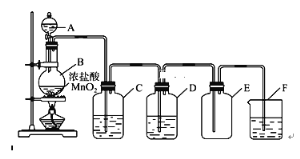
(1)写出实验室制备氯气的化学反应方程式:____________________________________。
(2)在反应中MnO2发生______(填“氧化”或“还原”,下同)反应,Cl2是______产物。
(3)装置C中所装试剂为________,其作用为_______________________________。
(4)检验氯气是否收集满的方法为:_________________________________________。
(5)F中反应的离子反应方程式为_________________________________________。
(6)工业上常用氯气与石灰水反应制备漂白粉,而久置漂白粉容易失效,请写出漂白粉失效的原理____________________________,_______________________________(用化学方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式书写正确的是
A. CH3COOH=CH3COO-+H+ B. Ba(OH)2=Ba2++(OH-)2
C. H2CO3![]() 2H++CO32- D. Ca(NO3)2=Ca2++2NO3-
2H++CO32- D. Ca(NO3)2=Ca2++2NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.我国的青海省有许多盐湖盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用。粗盐中含Ca2+、Mg2+、SO42-以及泥沙等杂质,为了除去可溶性杂质,有以下实验步骤进行提纯:
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。
(1)以下操作顺序不合理的是 _______。
A.②⑤④③① B.④⑤②①③
C.⑤②④①③ D.⑤④②①③
(2)步骤①中所用的玻璃仪器有烧杯、______________、_____________。
(3)通过步骤①中过滤后的滤液,检验SO42-是否除尽的操作方法是__________
Ⅱ.碘是人体所需的必需元素,海洋植物如海带海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室从海洋植物中提取碘的流程如下:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ―→
―→![]()
(1)上述过程灼烧海藻是在____________(填仪器名称)中进行。
(2)上述步骤②中是加入了氯水,利用氯水中的Cl2把I-氧化为I2,请写出该反应的离子方程式_____________。
(3)上述步骤③中加入了CCl4后进行振荡,振荡后静置分层,上层______色,下层_______色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计了如图装置,该装置能制取Cl2,并进行相关性质实验,且可利用装置G储存多余的氯气。
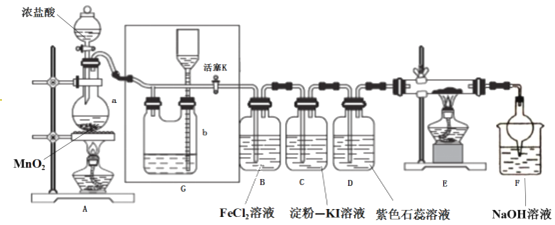
(1)A中发生反应的化学反应方程式为_________________________
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯,回答下列问题:
①在装置C、D中能看到的实验现象分别是 __________________ 、_______________ ;
②在装置E的硬质玻璃管内盛有碳粉,发生氧化还原反应,产物为CO2和HCl,则E中发生反应的化学方程式为______________________________;
③装置F中球形干燥管的作用是____________________________;
(3)储气瓶b内盛放的试剂是______________________________;
(4)实验结束后,某同学想检验B瓶内液体是否完全与Cl2反应,可采用的方法是: __________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知草酸(H2C2O4)可使H2SO4酸化的KMnO4溶液褪色,请回答以下问题:
①在该反应中0.2mol高锰酸钾可得到1mol电子,该反应的还原产物为________(写化学式)
②请补全并配平该反应方程式:
___H2C2O4+ KMnO4+ H2SO4 → K2SO4+ + CO2↑ + H2O
(2)某溶液中可能含有以下离子:Na+、K+、Fe3+、CO32-、SO42-、Cl-,现进行如下实验:

根据实验现象回答:
该溶液中一定含有的离子是______________;一定不含有的离子是____________;无法确定的离子是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是最理想的太阳能电池材料,高性能晶硅电池是建立在高质量晶硅材料基础上的。工业上可以用如图所示的流程制取高纯硅。

(1)硅在周期表中的位置是_______________,反应1中氧化剂与还原剂的物质的量之比为:__________________
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3 (沸点31.8℃)中含有少量SiCl4 (沸点57.6℃)和SiH2Cl2 (沸点8.2℃)、SiH3Cl(沸点-30.4℃)提纯SiHCl3采用的方法为__________,整个过程中可以循环利用的物质X是:_____________(填化学式)
(3)提纯粗硅的过程中必须严格控制无水无氧,原因之一是硅的卤化物极易水解,写出SiCl4遇水剧烈反应的化学方程式___________________________________
(4)硅在有HNO3存在的条件下,可以与HF生成H2SiF6,同时有不溶于水的气体生成,该气体遇空气变为红棕色,硅单质发生的化学方程式为_____________________________________________________
(5)某工厂用100吨纯度为75%的石英砂为原料经第一步反应制得的粗硅中含硅28吨,则该过程中硅的产率是:__________(精确到小数点后两位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com