
室温时冰醋酸加水稀释过程中导电能力的变化如图所示。溶液的导电性体现了溶液中离子浓度大小。一般来说,溶液导电能力越强,离子浓度越大。
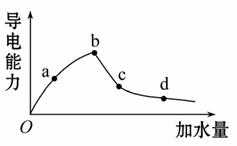
(1)图中O点[H+]=________mol·L-1。
(2)a、b、c、d四点中溶液的[H+]大小顺序为____________。电离程度大小顺序为______。电离平衡常数大小顺序为__________。(用“>”“=”或“<”来表示)
(3)若要使c点溶液中[CH3COO-]增大,而又不产生气体,则下列措施中可选择
_______ _。
_。
A.加水 B.加热
C.加锌粒 D.加固体NaOH
E.加很稀的 NaOH溶液 F.加固体CH3COON
NaOH溶液 F.加固体CH3COON a
a
(4)设d点醋酸溶液的浓度为c mol·L-1,此温度下醋酸的电离常数为Ka mol·L-1,达到平衡时醋酸分子浓度可近似为c mol·L-1,求平衡时溶液的pH(用Ka和c表示)。
(1)纯弱电解质一般情况下电离很弱,可忽略。
(2)稀释醋酸,向电离方向移动。但[H +]并不始终增大,一般来说浓度小于
+]并不始终增大,一般来说浓度小于
0.1 mol·L-1,溶液越稀,离子浓度越小。而电离平衡常数只与温度有关,与浓度无关。
(3)A项,加水会使[CH3COO-]减小。B项,加热使电离平衡正向移动,[CH3COO-]增大。C项,加锌粒会 产生气体。D项,加NaOH固
产生气体。D项,加NaOH固 体与H+反应,使平衡正向移动,[CH3COO-]增大。E项,加很稀的NaOH溶液等同于加水。F项,直接加固体CH3COONa使[CH3COO-]增大。
体与H+反应,使平衡正向移动,[CH3COO-]增大。E项,加很稀的NaOH溶液等同于加水。F项,直接加固体CH3COONa使[CH3COO-]增大。
(4)CH3COOH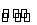 CH3COO- + H+
CH3COO- + H+
c x x

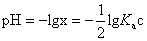
答案:(1)0
(2)b>a>c>d d>c>b>a a=b=c=d
(3)B、D、F
(4)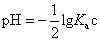


科目:高中化学 来源: 题型:
“绿色化学”又称环境无公害化学,下列叙述不符合“绿色化学”思想的是( )
A.开发高效氢能、太阳能等新型电动汽车,以解决城市机动车尾气排放问题
B.大力开发利用可燃冰(固态甲烷水合物),以缓解能源紧缺
C.研制新型杀虫剂,使它只对目标昆虫有毒杀作用而对其他昆虫无害
D.工业上用废铜制取胆矾CuSO4·5H2O:
2Cu+O2+2H2SO4(稀)+8H2O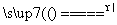 2CuSO4·5H2O
2CuSO4·5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制取C1O2的化学反应:2 NaClO3+SO2+H2SO4 ==2C1O2+2 NaHSO4,下列说法正确的是( )
A.SO2在反应中被氧化B.NaC1O3在反应中失去电子
C.H2SO4在反应中作氧化剂 D.1mol还原剂在反应中失去1 mo l电子
查看答案和解析>>
科目:高中化学 来源: 题型:
1.下列制备金属单质的方法或原理正确的是( )
A.在高温条件下,用H2还原MgO制备单质Mg
B.在通电条件下,电解熔融Al2O3制备单质Al
C.在通电条件下,电解饱和食盐水制备单质Na
D.加强热,使CuO在高温条件下分解制备单质Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于弱电解质的电离平衡常数的叙述中,正确的是( )
A.因为电离是吸热的,所以温度越高,同一弱电解质的电离平衡常数越小
B.弱电解质的电 离平衡常数只与弱电解质的本性及外界温度有关
离平衡常数只与弱电解质的本性及外界温度有关
C.同一温度下,弱酸的电离平衡常数越大,酸性越强;弱碱的电离平衡常数越大,碱性越弱
D.多元弱酸的各级电离常数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
把0.05 mol NaOH固体分别加入到100 mL下列液体中,溶液的导电能力变化最小的是( )
A.自来水
B.0.5 mol·L-1盐酸
C.0.5 mol·L-1 CH3COOH溶液
D.0.5 mol·L-1 KCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A:4HCl+O2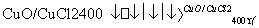 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.反应A中, 4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.

(1)反应A的热化学方程式是____________________________________________________。
(2)断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为________kJ,H2O中H—O 键比HCl中H—Cl键(填“强”或“弱”)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)白色的Fe(OH)2在空气中发生的颜色变化为
________________________;
(2)写出硅酸钠溶液在空气中变质的化学方程式:
____________________________;
(3)写出用熟石灰吸收氯气制漂白粉的化学方程式:
;
(4)将CaMg3Si4O12改写为氧化物的形式:[gkstk.Com]
__________________________________。[学优高考网gkstk]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com