
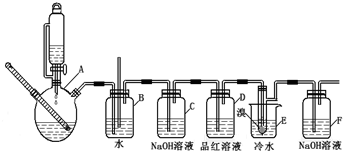
 高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:分析 (1)①根据实验装置图可知,左边集气瓶的作用是混合SO2和N2;
②石灰乳的作用是吸收尾气二氧化硫,碱和酸性氧化物反应得到对应的盐和水;
③MnO2做氧化剂把亚硫酸氧化为硫酸,自身被还原为Mn2+,据此书写反应的离子方程式;
④为使SO2尽可能转化完全,一定要保证控制反应的温度,在通入SO2和N2比例一定、不改变固液投料的条件下,要求所通气体一定要慢;
(2)制取的原理是碳酸根和锰离子之间反应生成碳酸锰的过程,但要考虑MnCO3难溶于水、乙醇并在潮湿时易被空气氧化,100℃开始分解以及Mn(OH)2开始沉淀时pH=7.7等因素,过程中控制溶液的PH值以及洗涤沉淀所选的溶剂要小心,据此答题.
解答 解:(1)①左边集气瓶的作用是混合SO2和N2 ,
故答案为:混合SO2和N2;
②石灰乳的作用是吸收尾气二氧化硫,碱和酸性氧化物反应得到对应的盐和水,反应为SO2+Ca(OH)2=CaSO3+H2O,
故答案为:SO2+Ca(OH)2=CaSO3+H2O;
③MnO2做氧化剂把亚硫酸氧化为硫酸,自身被还原为Mn2+,故反应的离子方程式为:MnO2+H2SO3=Mn2++SO42-+H2O,
故答案为:MnO2+H2SO3=Mn2++SO42-+H2O;
④使SO2尽可能转化完全,应定要保证控制反应的温度,在通入SO2和N2比例一定、不改变固液投料的条件下,要求所通气体一定要慢,故选ac;
(2)制取的原理是碳酸根和锰离子之间反应生成碳酸锰的过程,但要考虑MnCO3难溶于水、乙醇并在潮湿时易被空气氧化,100℃开始分解以及Mn(OH)2开始沉淀时pH=7.7等因素,过程中控制溶液的PH值以及洗涤沉淀所选的溶剂要小心,所以实验步骤为边搅拌边加入碳酸钠或碳酸氢钠,并控制溶液的PH<7.7、过滤,用水洗涤2-3次、检验SO42-是否被除去,此时必须用盐酸将溶液酸化,用少量的乙醇洗涤,
故答案为:过滤,水洗2~3次;是; C2H5OH.
点评 本题主要考查了制备高纯碳酸锰实验方案,读懂工艺流程,正确识图、理解离子反应的本质是解答的关键,本题实验综合性强,难度中等.


科目:高中化学 来源:2017届江苏省高三上学期月考一化学试卷(解析版) 题型:选择题
一种三室微生物燃料电池污水净化系统原理如右图所示,图中有机废水中有机物可用C6H10O5表示。下列有关说法正确的是

A.b电极为该电池的负极
B.b电极附近溶液的pH减小
C.a电极反应式:C6H10O5-24e-+7H2O===6CO2↑+24H+
D.中间室:Na+移向左室,Cl-移向右室
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期中化学试卷(解析版) 题型:选择题
ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为
A.1︰1 B. 2︰1 C. 1︰2 D. 2︰3
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置,以苯甲酸、甲醇为原料制取苯甲酸甲酯,有关物质的物理性质见表:
苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置,以苯甲酸、甲醇为原料制取苯甲酸甲酯,有关物质的物理性质见表:| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 浓度/g•cm3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
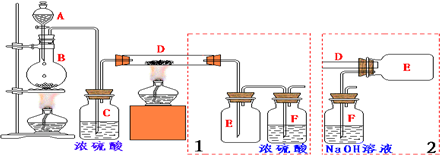
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com