
| A. | N4的摩尔质量是56 g | |
| B. | N4与N2互为同位素 | |
| C. | 相同质量的N4和N2含原子个数比为1:2 | |
| D. | N4与N2互为同素异形体 |
分析 A.N4的摩尔质量是56 g/mol;
B.N4与N2是氮元素组成的不同单质;
C.N4和N2均由N原子构成,二者质量相等,含有N原子数目相等;
D.N4与N2是氮元素组成的不同单质.
解答 解:A.1molN4的质量为56g,而N4的摩尔质量是56 g/mol,故A错误;
B.同位素研究对象为原子,N4与N2是氮元素组成的不同单质,二者互为同素异形体,故B错误;
C.N4和N2均由N原子构成,二者质量相等,含有N原子数目相等,相同质量的N4和N2含原子个数比为1:1,故C错误;
D.N4与N2是氮元素组成的不同单质,二者互为同素异形体,故D正确,
故选D.
点评 本题考查摩尔质量、同位素、同素异形体、物质的量有关计算,比较基础,有利于基础知识的巩固.


科目:高中化学 来源: 题型:解答题
| 原子序数 | 电子排布式 | 价层电子排布 | 周期 | 族 |
| 17 | ①1s2 2s22p6 3s23p5 | ②3s23p5 | ③3 | ④ⅤⅡA |
| ⑤10 | 1s22s22p6 | ⑥2s22p6 | ⑦2 | ⑧0 |
| ⑨24 | ⑩1s2 2s22p6 3s23p63d5 4s1 | 3d54s1 | (11) | ⅥB |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①②④⑤ | C. | ①②③⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 焦亚硫酸钠(Na2S2O5)是一种常用的抗氧化剂.某研究小组对焦亚硫酸钠进行如下研究:
焦亚硫酸钠(Na2S2O5)是一种常用的抗氧化剂.某研究小组对焦亚硫酸钠进行如下研究:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 未成对电子数 | 电负性 | 气态氢化物稳定性 | 酸性 |
| N>O | C<N | H2S<H2O | H2SO4<HClO4 |
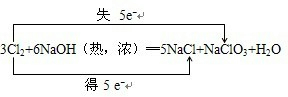 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④ | C. | ③④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳和水蒸汽的反应是吸热反应,如图所示是碳和水蒸气发生反应生成CO、H2的途径和三个状态的能量(E),试回答下列问题:
碳和水蒸汽的反应是吸热反应,如图所示是碳和水蒸气发生反应生成CO、H2的途径和三个状态的能量(E),试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | A的初$\frac{始浓度}{mol•{L}^{-1}}$ | B的初$\frac{始浓度}{mol•{L}^{-1}}$ | 生成C的$\frac{初始速率}{mol•{L}^{-1}•{s}^{-1}}$ |
| 1 | 1.0 | 1.0 | 1.2×10-2 |
| 2 | 2.0 | 1.0 | 2.4×10-2 |
| 3 | 4.0 | 1.0 | 4.9×10-2 |
| 4 | 1.0 | 1.0 | 1.2×10-2 |
| 5 | 1.0 | 2.0 | 4.8×10-2 |
| 6 | 1.0 | 4.0 | 1.9×10-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com