
 请回答下列问题.
请回答下列问题.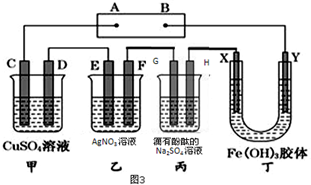
| 2.24g |
| 64g/mol |


科目:高中化学 来源: 题型:
| A、常温下,浓硫酸、浓硝酸均能将金属铜氧化,且均能使铁钝化 |
| B、乙烯常用作植物催熟剂,乙酸常用作调味剂,乙醇常用于杀菌消毒 |
| C、玛瑙、水晶、钻石的主要成分均为SiO2 |
| D、蛋白质、纤维素、蔗糖、天然橡胶都是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na在氧气中燃烧主要生成Na2O |
| B、将SO2通入CaCl2溶液可生成CaSO3沉淀 |
| C、将CO2通入次氯酸钙溶液可生成次氯酸 |
| D、将NH3通入热的CuSO4溶液中能使Cu2+还原成Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、四种元素的原子半径:A<B<C<D |
| B、四种元素A、B、C、D的氧化物都不止一种 |
| C、由B与A组成的化合物的沸点一定低于由C与A组成的化合物的沸点 |
| D、CaA2、CaB2这两种化合物中,阳离子与阴离子个数比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硼电负性和硅相近 |
| B、BCl3、PCl5、H2O三种分子的中心原子的最外层电子均不满足8e-稳定结构 |
| C、原子和其它原子形成共价键时,其共价键数一定等于原子的价电子数 |
| D、组成和结构相似的物质随相对分子质量的增大,熔沸点升高,所以NO的沸点应该介于N2和O2之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y |
| Z |
| A、①②③④ | B、①②④ |
| C、②④ | D、①② |
查看答案和解析>>
科目:高中化学 来源: 题型:
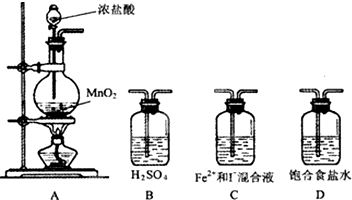 某研究性学习小组设想将少量Cl2通入Fe2+和I-的混合溶液,来探究Fe2+和I-的还原性强弱.
某研究性学习小组设想将少量Cl2通入Fe2+和I-的混合溶液,来探究Fe2+和I-的还原性强弱.| 实验步骤 | 预期现象与结论 |
| 取少量反应的溶液置于A、B两支试管中; 向A试管中滴加 向B试管中滴加 | ①若 ②若 ③若 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新型合成氨方法是吸热反应 |
| B、新型合成氨方法可简化生产设备 |
| C、新型催化剂提高了N2和H2的转化率 |
| D、两种方法中该反应的化学平衡常数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
2- 3 |
- 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com