
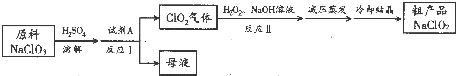
分析 NaClO3和浓H2SO4在反应器I中发生还原反应生成ClO2和Na2SO4,所以试剂A可以用二氧化硫,ClO2在反应器II中与双氧水、氢氧化钠反应生成亚氯酸钠,再得到其晶体,
(1)根据上面的分析可判断试剂A;
(2)反应Ⅱ中ClO2被双氧水还原成ClO2-,根据元素守恒和电荷守恒书写的离子方程式;
(3)根据信息纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全,所以要持续通过量的空气,NaClO2在碱性溶液中稳定存在,在酸性溶液中迅速分解,所以反应Ⅱ中碱要过量,因为试剂A为二氧化硫,NaClO3被还原成ClO2,所以反应Ⅰ后得到的母液中,溶质的主要成分是Na2SO4;
(4)含水NaClO2受热易分解,所以亚氯酸钠溶液中获得晶体,温度不能太高;
(5)用ClO2处理泄漏的氰化钠(NaCN),得到无毒的NaCl、N2 和CO2,根据电子得失守恒可知关系式ClO2~NaCN,根据NaCN 的物质的量,结合关系式可计算出需要ClO2 的质量.
解答 解:NaClO3和浓H2SO4在反应器I中发生还原反应生成ClO2和Na2SO4,所以试剂A可以用二氧化硫,ClO2在反应器II中与双氧水、氢氧化钠反应生成亚氯酸钠,再得到其晶体,
(1)根据上面的分析可知试剂A为SO2,故选a,故答案为:a;
(2)反应Ⅱ中ClO2被双氧水还原成ClO2-,反应的离子方程式为2ClO2+H2O2+2OH-═2ClO2-+2H2O+O2,
故答案为:2ClO2+H2O2+2OH-═2ClO2-+2H2O+O2;
(3)根据信息纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全,所以要持续通过量的空气,NaClO2在碱性溶液中稳定存在,在酸性溶液中迅速分解,所以反应Ⅱ中碱要过量,因为试剂A为二氧化硫,NaClO3被还原成ClO2,所以反应Ⅰ后得到的母液中,溶质的主要成分是Na2SO4,
故选ac,故答案为:ac;
(4)含水NaClO2受热易分解,所以亚氯酸钠溶液中获得晶体,温度不能太高,所以反应Ⅱ结束后采用“减压蒸发”操作,在较低温度蒸发浓缩,可防止温度过高NaClO2分解,
故答案为:在较低温度蒸发浓缩,可防止温度过高NaClO2分解;
(5)用ClO2处理泄漏的氰化钠(NaCN),得到无毒的NaCl、N2 和CO2,根据电子得失守恒可知关系式ClO2~NaCN,NaCN 的物质的量为 4×10-5mol•L-1×1000L=0.04mol,结合关系式可计算出需要ClO2 的质量为0.04mol×67.5g/mol=2.7g,
故答案为:2.7.
点评 本题考查物质的制备实验的工业设计,题目难度中等,本题注意把握物质的性质,从质量守恒的角度以及氧化还原反应的特点判断生成物,为解答该题的关键,也是易错点.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
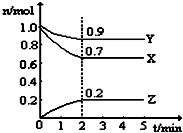 某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:
某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 判断该反应达到平衡的依据是CO、H2O、CO2、H2的浓度都相等 | |
| B. | 反应放出的热量为0.04 a kJ | |
| C. | 平衡时H2O的转化率为40% | |
| D. | 若将容器的体积压缩为1 L,有利于该反应平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 托盘天平称取NaCl的质量 | 应选用容量瓶的规格(可供选择的规格100mL、250mL、500mL) | 除容量瓶外还需要的其它仪器 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
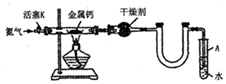
| 空瓷舟质量m0/g | 瓷舟与钙的质量m1/g | 瓷舟与产物的质量m2/g |
| 14.80 | 15.08 | 15.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1项 | B. | 2项 | C. | 3项 | D. | 4项 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com