
科目:高中化学 来源: 题型:选择题
| A. | 0.25 mol/L | B. | 0.30 mol/L | C. | 0.40 mol/L | D. | 0.50 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通式为CnH2n | |
| B. | 可以使酸性高锰酸钾溶液褪色 | |
| C. | 在光照下可与氯气发生加成反应 | |
| D. | 随分子中碳原子数的增加,烷烃的熔沸点升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平行光照射胶体产生丁达尔效应 | B. | 紫外线照射下,液态蛋白质凝固 | ||
| C. | SO2使品红溶液褪色 | D. | 铁遇到冷的浓硝酸溶液发生钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1:1 | B. | 6:1:1 | C. | 10:5:1 | D. | 15:5:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若△H>0,△S>0,低温时可自发进行 | |
| B. | 若△H<0,△S<0,低温时可自发进行 | |
| C. | 若△H<0,△S>0,任何温度下都能自发进行 | |
| D. | 若△H>0,△S<0,任何温度下都不能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
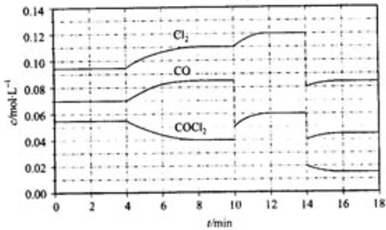
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v正(N2)=v逆(NH3) | B. | v正(N2)=3v正(H2) | ||
| C. | v正(H2)=$\frac{3}{2}$ v逆(NH3) | D. | N2、H2、NH3的体积比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

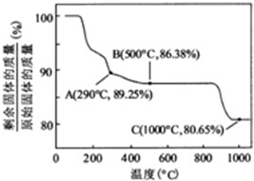
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com