
【题目】硝酸与金属反应时,浓度越稀还原产物价态越低。现用一定量的铝粉与镁粉组成的混合物与100ml硝酸钾溶液与硫酸组成的混合溶液充分反应,反应过程中无任何气体放出,向反应后的溶液中逐滴加入4.00mol/L的NaOH溶液,加入的溶液体积与产生的沉淀质量的关系如图所示。
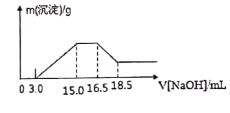
回答下列问题:
(1)写出铝与混合溶液反应的离子方程式:_________________
(2)参加反应硝酸根离子物质的量为____________mol
(3)参加反应的铝与镁的质量比为_______________
(4)混合液中硫酸的物质的量的浓度为_______________mol/L
【答案】8Al+30H++3NO3-=8Al3++3NH4++9H2O 0.006 3:4 0.36
【解析】
根据题干信息及物质的性质书写离子方程式;根据方程式及图表数据进行相关计算。
(1)硝酸根浓度很低时被氧化的产物是铵根离子,因此无气体放出,铝反应生成金属阳离子,则离子反应为8Al+30H++3NO3-=8Al3++3NH4++9H2O,
故答案为:8Al+30H++3NO3-=8Al3++3NH4++9H2O;
(2)由图示可以看出加入氢氧化钠溶液从15.0mL到16.5mL区间内发生的反应是氢氧根离子与铵根离子的反应,由氮原子守恒可知,铵根离子的物质的量即为原溶液中反应的硝酸根离子的物质的量,则原溶液中NO3-物质的量是(16.5-15)×10-3L×4mol/L=0.006mol,
故答案为:0.006;
(3)从图示提示中看出从氢氧化溶液体积16.5mL到18.5mL区间内发生的反应是氢氧化铝与氢氧化钠的反应,氢氧化铝与氢氧化钠等物质的量反应,由Al~Al3+~Al(OH)3~NaOH,则Al的物质的量为0.008mol,再由Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,沉淀镁离子和铝离子共消耗氢氧化钠溶液体积(15.0-3.0)mL,由此可知:沉淀镁离子时消耗的氢氧根离子物质的量为(15.0-3.0)×10-3L×4.00mol/L-8×10-3mol×3=24×10-3mol,镁离子物质的量为1.2×10-2mol,参加反应的镁与铝的质量之比:8×10-3mol×27g/mol:1.2×10-2mol×24g/mol=3:4,
故答案为:3:4;
(4)由4Mg+10H++NO3-═4Mg2++NH4++3H2O、8Al+30H++3NO3-=8Al3++3NH4++9H2O知,消耗氢离子为0.008mol×30/8+1.2×10-2mol×10/4=0.06mol,图中开始3.0mLNaOH溶液消耗氢离子的物质的量为3×10-3L×4mol/L=0.012mol,原溶液中硫酸的物质的量为(0.06mol+0.012mol)/2=0.036mol,混合液中硫酸的物质的量的浓度为0.036mol/0.1L=0.36mol/L,
故答案为:0.36。


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】已知15.5 g CO、HCOOCH3、HCHO、CH3COOH的混合物在O2中完全燃烧都生成水和CO2,将其产物通过足量的Na2O2后,则Na2O2固体增重为( )
A.14.7 gB.16.1 gC.15.5 gD.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时 H2C2O4 的 pKa1=1.22,pKa2=4.19,CH3COOH 的 pK a=4.76,K 代表电离平衡常数,pK = -1gK。下列说法正确的是
A. 浓度均为 0.1mol·L-1NH4HC2O4 和 CH3COONH4 溶液中:c(NH4+)前者小于后者
B. 将 0.1mol·L-1 的 K2C2O4 溶液从 25℃升温至 35℃,c(K+)/c (C2O42-) 减小
C. 0.1 mol·L-1K2C2O4 溶液滴加盐酸至 pH=1.22:c(H+)-c(OH-)=c(Cl-)-3c(HC2O4-)
D. 向 0.1 mol·L-1CH3COONa 溶液中滴加少量 0.1 mol·L-1H2C2O4 溶液:CH3COO- + H2C2O4 = CH3COOH + HC2O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一枚洁净的铁钉浸入稀硫酸中,下列叙述正确的是( )
①铁钉表面产生气泡 ②溶液由无色逐渐变为浅绿色 ③铁钉的质量减轻 ④溶液的质量减轻
A.②③B.①②④C.①②③D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温、常压和光照条件下,N2在催化剂表面与H2O发生反应:2N2(g)+6H2O(l) =4NH3(g)+3O2(g)。在2 L的密闭容器中,起始反应物用量相同,催化剂的使用情况也相同,控制不同温度分别进行4组实验,3 h后测定NH3的生成量,所得数据如下表:
实验级别 | 实验1 | 实验2 | 实验3 | 实验4 |
温度/K | 303 | 313 | 323 | 353 |
NH3生成量/106mol | 4.8 | 5.9 | 6.0 | 2.0 |
下列说法不正确的是
A. 温度为303 K时,在3 h内用氮气表示的平均反应速率为4×107mol·L1·h1
B. 实验1和实验3中,3 h内N2的转化率之比为4:5
C. 分析四组实验数据可得出,温度升高可加快反应速率,也可能减慢反应速率
D. 353 K时,可能是催化剂催化活性下降或部分水脱离催化剂表面,致使化学反应速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:_____与盐酸反应最剧烈,____与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明非金属性:Cl____S(填“>”或“<”),反应的离子方程式为_______。
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律。

(3)仪器A的名称为___________,干燥管D的作用为___________________。
(4)若要证明非金属性:Cl>I,C中为淀粉—碘化钾混合溶液,B中装有KMnO4固体,则A中试剂为___________,观察到C中溶液____________(填现象),即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用_________溶液吸收尾气。
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液。观察到C中溶液 ________(填现象),即可证明。但有的同学认为盐酸具有挥发性,HCl可进入C中干扰实验,应在两装置间添加装有 _________溶液的洗气瓶除去。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com