
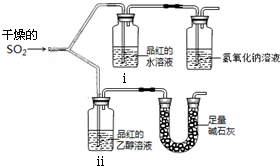
 实验小组为探究SO2的漂白性和还原性,设计了以下实验.完成下列填空:
实验小组为探究SO2的漂白性和还原性,设计了以下实验.完成下列填空:分析 (1)硫酸和亚硫酸钠固体制取二氧化硫发生的是离子反应,如果硫酸浓度过大,硫酸是以分子形式存在,电离出H+很少,不能反应生成SO2,如果硫酸浓度过低,二氧化硫易溶于水,不利于二氧化硫放出;
(2)①实验目的是验证干燥的二氧化硫能否漂白品红,应避免空气中水蒸气加入,SO2对环境有污染,需要尾气处理;
②SO2不能使品红的乙醇溶液褪色,而其水溶液可以,使品红褪色的微粒含有S元素;
(3)亚硫酸钠和亚硫酸氢钠都能水解生成亚硫酸,且亚硫酸氢根离子能电离生成亚硫酸根离子,所以两种溶液中都含有HSO3-、SO32-、H2SO3;
(4)①铁离子具有强氧化性,在溶液中可以将二氧化硫氧化为硫酸根;利用盐酸酸化的氯化钡溶液检验硫酸根离子;
②混合液中存在平衡FeSO3(s)?Fe2+(aq)+SO32-(aq),Fe3+会与SO32-发生氧化还原反应,使平衡右移,最终生成FeSO4溶液.
解答 解:(1).硫酸和亚硫酸钠固体制取二氧化硫发生的是离子反应,98%浓硫酸中硫酸是以分子形式存在,c(H+)小不易反应,10%硫酸溶液水含量高,二氧化硫易溶于水,不易使SO2放出,所以选取70%硫酸,
故答案为:b;98%浓硫酸中c(H+)小不易反应,10%硫酸溶液水含量高不易使SO2放出;
(2)①实验目的是验证干燥的二氧化硫能否漂白品红,应避免空气中水蒸气加入,SO2对环境有污染,需要吸收处理,故碱石灰的作用是防止空气中的水蒸气进入ⅱ中干扰实验,吸收二氧化硫防污染,
故答案为:防止空气中的水蒸气进入ⅱ中干扰实验,吸收二氧化硫防污染;
②SO2不能使口红褪色,而其水溶液可以,因此使品红褪色的微粒可能是H2SO3、HSO3-、SO32-,
故答案为:H2SO3、HSO3-、SO32-;
(3)亚硫酸钠和亚硫酸氢钠都能水解生成亚硫酸,且亚硫酸氢根离子能电离生成亚硫酸根离子,所以两种溶液中都含有HSO3-、SO32-、H2SO3,所以不能确定使品红褪色的微粒肯定是HSO3-或SO32-,
故答案为:不正确,因为SO32-离子和HSO3-离子都会水解生成H2SO3;
(4)①SO2与FeCl3反应的离子方程式是:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,检验SO42-的方法是:取少量反应混合液,加入盐酸酸化后加氯化钡溶液,产生白色沉淀,混合液中即含有SO42-,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;取少量反应混合液,加入盐酸酸化后加氯化钡溶液,产生白色沉淀,混合液中即含有SO42-;
②混合液中存在平衡FeSO3(s)?Fe2+(aq)+SO32-(aq),Fe3+会与SO32-发生氧化还原反应,使平衡右移,墨绿色沉淀溶解,最终生成浅绿色FeSO4溶液,
故答案为:混合液中存在平衡FeSO3(s)?Fe2+(aq)+SO32-(aq),Fe3+会与SO32-发生氧化还原反应,使平衡右移,墨绿色沉淀溶解,最终生成浅绿色FeSO4溶液.
点评 本题考查性质实验方案的设计,侧考查学生对原理的理解分析,熟练掌握元素化合物知识以及对化学反应原理的理解应用,难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
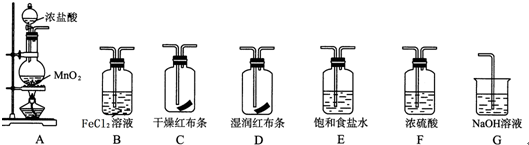
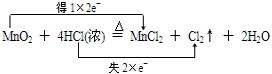 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、乙醇和乙酸都能发生取代反应 | |
| B. | 等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等 | |
| C. | 乙醇、乙酸和乙酸乙酯能用饱和NaHCO3溶液鉴别 | |
| D. | 乙烷和丙烯的物质的量各1mol,完成燃烧生成3molH2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1 mol H2SO4与1 mol Ba(OH)2完全中和所放出的热量为中和热 | |
| B. | 由C(石墨)→C(金刚石)△H=+119 kJ•mol-1可知,石墨比金刚石稳定 | |
| C. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ•mol-1 | |
| D. | 在101 kPa,298 K条件下,1 mol S和2 mol S的燃烧热相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
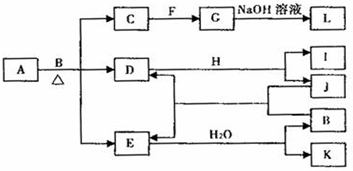
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
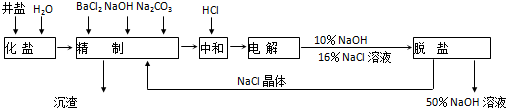
| 温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| NaOH/g | 109 | 118 | 129 | 146 | 177 | 300 | 313 | 318 | 337 |
| NaCl/g | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com