
| A. | 500 ml,1mol/LFe2(SO4)3溶液和250mL 3mol/L的Na2SO4溶液所含硫酸根离子的物质的量浓度相等 | |
| B. | 若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q | |
| C. | 1.2gNaHSO4晶体中阳离子和阴离子的总数为0.03NA | |
| D. | 含NA个Na+的Na2O溶解于1L水中.Na+的物质的量浓度为lmol/L |
分析 A、LFe2(SO4)3溶液中硫酸根的浓度是硫酸铁浓度的三倍;而在硫酸钠溶液中,硫酸根浓度和硫酸钠浓度相同;
B、非金属性的强弱和最高价含氧酸的酸性强弱有关;
C、求出硫酸氢钠的物质的量,然后根据硫酸氢钠晶体由钠离子和硫酸氢根构成来分析;
D、氧化钠溶于1L水中后,溶液体积大于1L.
解答 解:A、Fe2(SO4)3溶液中硫酸根的浓度是硫酸铁浓度的三倍,故1mol/LFe2(SO4)3溶液中硫酸根的浓度为3mol/L;而在硫酸钠溶液中,硫酸根浓度和硫酸钠浓度相同,故在3mol/L的Na2SO4溶液中,硫酸根浓度为3mol/L,两溶液中的硫酸根浓度相同,故A正确;
B、非金属性的强弱和最高价含氧酸的酸性强弱有关,故若R的最高价含氧酸的酸性强于Q的最高价含氧酸的酸性,则R的非金属性强于Q,故B错误;
C、1.2g硫酸氢钠的物质的量为0.01mol,而硫酸氢钠晶体由钠离子和硫酸氢根构成,故0.01mol硫酸氢钠中含离子共0.02NA个,故C错误;
D、氧化钠溶于1L水中后,溶液体积大于1L,故溶液中的钠离子的浓度小于1mol/L,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数常数和物质的量浓度的计算,应注意到在公式c=$\frac{n}{V}$中,V指的是溶液的体积,而非溶剂的体积.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 铝片不用特殊方法保护 | |
| B. | 轮船水线下的船体上装一定数量的锌块 | |
| C. | 不纯的铁在潮湿的空气中生锈 | |
| D. | 镀锌铁比较耐用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时,电池正极上发生的反应为:PbO2+2e-+4H++SO42-=PbSO4+2H2O | |
| B. | 充电时,Pb应相连直流电源的正极 | |
| C. | 放电时,负极质量每增重9.6g,溶液中就消耗0.4molH+ | |
| D. | 需要定期补充硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
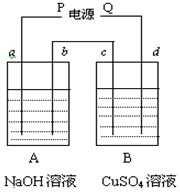 按如图装置实验,a、b、c、d均为惰性电极,A、B两烧杯中分别盛放NaOH溶液和足量CuSO4溶液.通电一段时间后,c电极质量增加6.4g,试回答:
按如图装置实验,a、b、c、d均为惰性电极,A、B两烧杯中分别盛放NaOH溶液和足量CuSO4溶液.通电一段时间后,c电极质量增加6.4g,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 出现环境 | 实验事实 | |
| A | 以稀H2SO4为电解质的Cu-Zn原电池 | Cu为正极,正极上发生还原反应 |
| B | 电解CuCl2溶液 | 电子经过负极→阴极$\stackrel{通过电解液}{→}$阳极→正极 |
| C | 弱酸性环境下钢铁腐蚀 | 负极处产生H2,正极处吸收O2 |
| D | 将钢闸门与外加电源负极相连 | 牺牲阳极阴极保护法,可防止钢闸门腐蚀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ②④ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com