
| A. | NaH2PO4、Na2HPO4 | B. | Na2CO3、NaHCO3 | C. | NaHSO4、NaHCO3 | D. | Na2SO4、CH3COONa |
 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:选择题
| A. | 150mL 3mol/LKCl溶液 | B. | 150m L 1mol/LAlCl3溶液 | ||
| C. | 50mL3mol/LMgCl2溶液 | D. | 75mL 1.5mol/LMgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
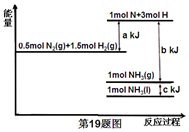
| A. | N2(g)+3H2(g)=2NH3(g)△H=-(b-a)kJ•mol-1 | |
| B. | N2(g)+3H2(g)=2NH3(g)△H=-(a-b)kJ•mol-1 | |
| C. | 2NH3(1)=N2(g)+3H2(g)△H=2(a+b-c)kJ•mol-1 | |
| D. | 2NH3(1)=N2(g)+3H2(g)△H=2(b+c-a)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体属于介稳体系 | |
| B. | 蒸发操作中主要仪器是坩埚 | |
| C. | 粗盐经过溶解、过滤、蒸发后得到的是纯净的食盐 | |
| D. | NH4NO3不属于盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在空气中燃烧生成氧化钠 | |
| B. | 将钠投入滴有紫色石蕊试液的水中,水溶液变为红色 | |
| C. | 将一小块钠放在CuSO4溶液中发生反应离子方程式:2Na+Cu2+═2Na++Cu | |
| D. | 将4.6gNa投入到95.4g水中,所得溶液中溶质的质量分数大于8.0% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下2.24L O2 | |
| B. | 含NA个氢分子的H2 | |
| C. | 8.5g氨气(氨气的摩尔质量为17g•mol-1) | |
| D. | 含3.01×1022个分子的CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
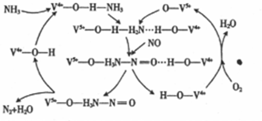

 | c(NH3)/mol•L-1 | c(O2)/mol•L-1 | c(NO)mol•L-1 |
| 0 | 1.2 | 1.75 | 0 |
| 4min | 0.4 | 0.75 | 0.8 |
| 6min | 0.4 | 0.75 | 0.8 |
| 8min | 0.6 | 1 | 0.6 |
| 9min | 0.6 | 1 | 0.6 |
| 10min | 1.05 | 1 | 1.05 |
| 12min | … | … | … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com